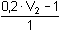|
- Příklad 5.142




- Jaké objemy 0,1M-HCl a 0,05M-Na2B4O7 je třeba smísit,
abychom získali 10 ml tlumivého roztoku o pH 8,30 ? Uvažujte také vliv iontové síly roztoku,
kterou tvoří zhydrolyzovaný borax!
Řešení Tabulková hodnota disociační konstanty kyseliny borité: pKHA = 9,237 Hydrolýza boraxu probíhá podle rovnice:B4O72– + 5 H2O → 2 H3BO3 + 2 H2BO3–n(H3BO3) = n(H2BO3–) = n(B4O72–) · 2 a) Bude-li V1 ml objem 0,1M-HCl a objem boraxu V2 = (10 – V1) ml, pak látkové množství boritanu a kyseliny borité po přídavku HCl bude:n(H2BO3–) = (10 – V1)·0,05·2 – V1·0,1 mmoln(H3BO3) = (10 – V1)·0,05·2 + V1·0,1 mmol Řešení podle vztahu (76):8,30 = 9,237 + log 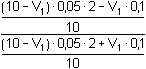 = 9,237 + log = 9,237 + log 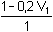 Výsledek: V1 = 4,42 ml 0,1M-HCl; V2 = 5,58 ml 0,05 molárního boraxu.Iontovou sílu roztoku tvoří zbývající boritan a Cl–-ionty: I = 0,1 8,30 = (9,237 – 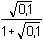 ) + log ) + log 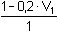 Výsledek: V1 = 4,00 ml 0,1M-HCl; V2 = 6,00 ml 0,05 molárního boraxub) Bude-li objem boraxu V2 ml a objem 0,1M-HCl V1 = (10 – V2) ml, pak látkové množství boritanu a kyseliny borité po přídavku HCl bude: n(H2BO3–) = V2·0,05·2 – (10 – V2)·0,1 mmoln(H3BO3) = V2·0,05·2 + (10 – V2)·0,1 mmol Podle vztahu (76):8,30 = 9,237 + log 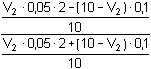 = 9,237 + log = 9,237 + log 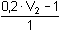 Výsledek: V2 = 5,58 ml 0,05 molárního boraxu; V1 = 4,42 ml 0,1M-HClVliv iontové síly: postup podle a). Zpět
|
|




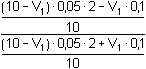 = 9,237 + log
= 9,237 + log 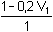
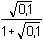 ) + log
) + log 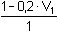
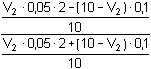 = 9,237 + log
= 9,237 + log