|
- Příklad 5.165




- Vypočtěte hodnotu pH roztoku vzniklého zneutralizováním 0,005 molární kyseliny sírové
roztokem 0,01M-NaOH z 10%! Počítejte také s iontovou sílou roztoku!
Řešení Původní koncentrace vodíkových iontů: c(H+) = c(H2SO4)·2 = 0,01 mol·l–1Výpočet výsledného objemu po přídavku NaOH pomocí rovnice (4) v kap. 3.1.1: 0,01·VNaOH = (2·0,005)·VH2SO4 / 10  0,01·VNaOH = 10–3·VH2SO4 0,01·VNaOH = 10–3·VH2SO4VNaOH = 0,1 · VH2SO4 Vcelk = VH2SO4 + VNaOH = 1,1 VH2SO4 a) Koncentrace H+ po přídavku NaOH (10% z 2·0,005 mol·l-1):[H+] = (2·0,005 – 0,001) / 1,1 = 8,18·10–3 mol·l–1  pH = 2,09 pH = 2,09 b) Iontovou sílu roztoku tvoří H+, SO42– a Na+:I = 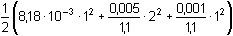 = 0,0136 = 0,0136fH+ = 0,885 aH+ = 8,18·10–3·0,885 = 7,239·10–3 mol·l–1  pH = 2,14 pH = 2,14 Zpět
|
|




 0,01·VNaOH = 10–3·VH2SO4
0,01·VNaOH = 10–3·VH2SO4 pH = 2,09
pH = 2,09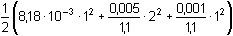 = 0,0136
= 0,0136