| |
| |
- Příklad 5.34




- Vypočtěte pH směsi 40 ml 0,15M-HCl a 60 ml 0,2M-KOH ! Počítejte s vlivem iontové síly roztoku!
Řešení Výpočet látkové koncentrace přebytečných OH–-iontů:(60·0,20) – (40·0,15) = 100 · c(OH–)  c(OH–) = 0,06 mmol·ml–1 = mol·l–1 c(OH–) = 0,06 mmol·ml–1 = mol·l–1 Iontovou sílu roztoku tvoří ionty OH–, K+ a Cl–:I = 0,5 (0,06·12 + 0,12·12 + 0,06·12) = 0,12 Výpočet aktivitního koeficientu (9) a aktivity OH–-iontu:–log fOH- = 0,509·12·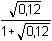 = 0,1310 = 0,1310  fOH- = 0,740 fOH- = 0,740a OH- = 0,06·0,740 = 0,0444 mol·l –1  pOH = 1,35 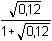 ) – 1,35 = 12,39 ) – 1,35 = 12,39 Zpět
|
| | |
|
|




 c(OH–) = 0,06 mmol·ml–1 = mol·l–1
c(OH–) = 0,06 mmol·ml–1 = mol·l–1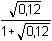 = 0,1310
= 0,1310  fOH- = 0,740
fOH- = 0,740 pOH = 1,35
pOH = 1,35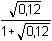 ) – 1,35 = 12,39
) – 1,35 = 12,39