|
Řešení Tabelovaná hodnota disociační konstanty: pKHAc = 4,756 tj. KHAc = 1,754·10–5Podle (31b):
podmínka správnosti: 3,64 < 1,30 + 2,52 = 3,82  nutno upřesnit nutno upřesnit
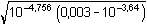 = 2,205·10–5 mol·l–1 = 2,205·10–5 mol·l–1pH = 3,66
kladný kořen rovnice: [H+] = 2,206·10–5 mol·l–1  pH = 3,66 pH = 3,66 | ||



