| |
| |
- Příklad 5.66




- Hydrazin je v 0,05 molárním roztoku disociován na 0,44%. Vypočtěte pH roztoku této zásady,
je-li koncentrace 0,0001 mol·l-1. N2H4 + H2O
 N2H5+
+ OH– N2H5+
+ OH–
Řešení Pro výpočet pH (pOH) zředěnějšího roztoku hydrazinu je třeba znát konstantu basicity. Vypočteme ji z uvedeného disociačního stupně (α = 0,0044).KB = 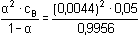 = 9,723·10–7 pKB = 6,01 = 9,723·10–7 pKB = 6,01 Hodnotu pH 0,0001 molárního roztoku se vypočítá podle rovnice (36):pH = pKw – pOH = 14 – 1/2(6,01 – log 0,0001) = 14 – 5,00 = 9,00ověření správnosti výpočtu pOH: 5,00 < 1,30 – log 0,0001 = 5,30 Upřesnění podle (37b):[OH–]2 + 9,723·10–7 · [OH–] – 9,723·10–7 · 10–4 = 0Kladný kořen rovnice: [OH–] = 9,386·10–6 mol·l–1  pOH = 5,03 pOH = 5,03 pH = 14 – 5,03 = 8,97 Zpět
|
| | |
|
|




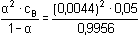 = 9,723·10–7 pKB = 6,01
= 9,723·10–7 pKB = 6,01 N2H5+
+ OH–
N2H5+
+ OH–
 pOH = 5,03
pOH = 5,03