|
- Příklad 5.94




- Jaké pH má 0,1 molární a 0,001 molární roztok benzoanu sodného?
Řešení Disociační konstanta kyseliny benzoové: KHA = 6,31·10–5, pKHA = 4,20a) Podle vztahu (55): pH = 1/2(pKw + pKHA + log cA-) = 1/2(14 + 4,20 + log 0,1) = 8,60Vliv iontové síly roztoku na pH: I = 0,1 pH = 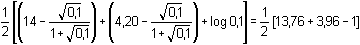 = 8,36 = 8,36 Výpočet pH s využitím stupně hydrolýzy podle (53) a (54):γ = 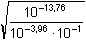 = 10–4,4 = 3,98·10–5 = 10–4,4 = 3,98·10–5pH = pKw,c + log (cA- · γ) = 13,76 + log (0,1 · 3,98·10–5) = 8,36 b) Výpočet pH 0,001 molárního roztoku – postup jako v případě a). Podle (55):pH = 1/2(14 + 4,20 + log 0,001) = 7,60 Podle (53) a (54):γ = 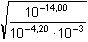 = 3,98·10–4 = 3,98·10–4  pH = 14 – 6,40 = 7,60 pH = 14 – 6,40 = 7,60 Zpět
|
|
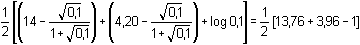 = 8,36
= 8,36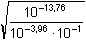 = 10–4,4 = 3,98·10–5
= 10–4,4 = 3,98·10–5



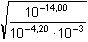 = 3,98·10–4
= 3,98·10–4  pH = 14 – 6,40 =
pH = 14 – 6,40 =