|
- Příklad 5.96




- Vypočítejte konstantu hydrolýzy Kh arsenitanu sodného koncentrace 0,001
mol·l-1! Výpočet proveďte pomocí stupně hydrolýzy, zjištěného podle rovnice
(52)!
Řešení pKHA = 9,294; KHA = 5,08·10–10a) Podle (52): γ2 + 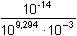 γ - γ - 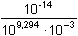 = 0 = 0  γ = 0,1308 γ = 0,1308 Konstanta hydrolýzy podle (51): Kh = 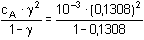 = 1,97·10-5 = 1,97·10-5
b) Další varianty výpočtu konstanty hydrolýzy: výpočet podle (53) a (51):γ = 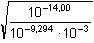 = 0,1403 = 0,1403 Protože hydrolýza probíhá v malé míře, lze ve vztahu (51) považovat (1 – γ) » 1; pakKh = cA- · γ2 = 0,001 · (0,1403)2 = 1,97·10-5 Podle (51) lze konstantu hydrolýzy vypočítat také z poměru Kw/KHA. Zpět
|
|




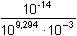 γ -
γ - 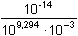 = 0
= 0  γ = 0,1308
γ = 0,1308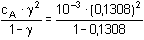 = 1,97·10-5
= 1,97·10-5