|
- Příklad 5.97




- Jaký je stupeň hydrolýzy γ a pH roztoku šťavelanu sodného
koncentrace 0,05 mol·l-1 bez a s vlivem iontové síly roztoku?
Řešení Disociační konstanty kyseliny šťavelové:pK1 = 1,25; K1 = 5,623·10–2pK2 = 4,285; K2 = 5,188·10–5 Hydrolýzu lze vyjádřit rovnicí: C2O42- + H2O  HC2O4- + OH– HC2O4- + OH– a) Bez vlivu iontové síly roztoku: Podle (53):γ = 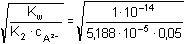 = 6,21·10-5 = 6,21·10-5 pH podle (54):pH = pKw + log (cA · γ) = 14 + log (0,05 · 6,21·10–5) = 8,49 pH podle (55):pH = 1/2(pKw + pK2 + log cC2O42-) = 1/2(14 + 4,285 + log 0,05) = 8,49 b) Vliv iontové síly roztoku: I = 1/2(0,1·12 + 0,05·22) = 0,15pK w,c = 14 – 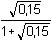 = 13,721 pK 2,c = 4,285 – 2 · 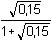 = 3,727 Podle (53):γ = 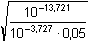 = 4,50·10-5 = 4,50·10-5 pH podle (54):pH = 13,721 + log (0,05 · 4,50·10–5) = 8,07 pH podle (55):pH = 1/2(13,721 + 3,727 + log 0,05) = 8,07 Zpět
| | |
|
|




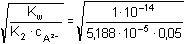 = 6,21·10-5
= 6,21·10-5