|
- Příklad 6.11




- Vypočítejte rovnovážné koncentrace všech složek systému, který vnikne smísením 100 ml 0,05
molárního roztoku Cu2+-iontů a 400 ml 0,1 molárního hydroxidu amonného!
Řešení Měďnatý ion tvoří s amoniakem pět komplexů, takže celková koncentrace kovového iontu zahrnuje šest složek (11).c(Cu) = [Cu2+] + [Cu(NH3)2+] + [Cu(NH3)22+] + [Cu(NH3)32+] + [Cu(NH3)42+] + [Cu(NH3)52+] Pro zjištění rovnovážné koncentrace jednotlivých složek v roztoku (podle (12), (13)) je třeba vypočítat rovnovážnou koncentraci ligandu. Obvykle se vychází z úvahy, že při dostatečném nadbytku ligandu je veškerý kovový ion vázán převážně do komplexu, který má nejvyšší hodnotu konstanty stability. V případě měďnatých ammin-komplexů má největší konstantu čtyřligandový komplex, je tedy nejméně disociován.Celkové koncentrace složek: c(Cu) = (100·0,05)/500 = 0,01 mmol·ml–1 = mol·l–1c(NH3) = (400·0,1)/500 = 0,08 mmol·ml–1 = mol·l–1 [NH3] = c(NH3) – 4 c(Cu) = 0,08 – 4·0,01 = 0,04 mol·l–1 = 10-1,40 mol·l–1 Rovnovážná koncentrace kovového iontu, vztah (12):[Cu2+] = 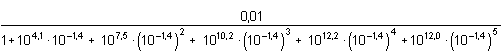 = == 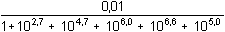 = 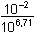 = 10 –8,71 mol·l –1 = 1,95·10–9 mol·l –1 Rovnovážné koncentrace komplexů, vztah (13):[Cu(NH3)2+] = 10–8,71·104,1·10-1,40 = 10–6,01 = 9,77·10–7 mol·l–1[Cu(NH3)22+] = 10–8,71·107,5·(10-1,40)2 = 10–4,01 = 9,77·10–5 mol·l–1 [Cu(NH3)32+]= 10–8,71·1010,2·(10-1,40)3 = 10–2,71 = 1,95·10–3 mol·l–1[Cu(NH3)42+]= 10–8,71·1012,2·(10-1,40)4 = 10–2,11 = 7,76·10–3 mol·l–1 [Cu(NH3)52+]= 10–8,71·1012,0·(10-1,40)5 = 10–3,71 = 1,95·10–4 mol·l–1 Ověření rovnovážné koncentrace ligandu:[NH3] = 0,08 – (9,77·10–7 + 2·9,77·10–5 + 3·1,95·10–3 + 4·7,76·10–3 + 5·1,95·10–4) == 0,08 – 0,038 = 0,042 mol·l–1 Rozdíl počáteční (0,04 mol·l–1) a výsledné (0,042 mol·l–1) rovnovážné koncentrace amoniaku je značný (5%). Další postup je aproximativní, při kterém se využívá nově zjištěné [NH3] a výpočet koncentrací všech složek se opakuje. Liší-li se nově vypočtená koncentrace [NH3] od předchozí o méně než 1%, aproximace se ukončí.Avšak nejvyšší komplex (pentammin-měďnatý), má konstantu stability, vzhledem k předchozímu komplexu, pouze 1,5krát nižší (Δβ = 100,2). Přesto, že není nejstabilnější, zvolme pro porovnání výsledků nyní komplex s pěti ligandy jako základ k výpočtu rovnovážné koncentrace amoniaku. [NH3] = c(NH3) – 5 c(Cu) = 0,08 – 5·0,01 = 0,03 mol·l–1 = 10–1,523 mol·l–1 Rovnovážná koncentrace kovového iontu, vztah (12):[Cu2+] = 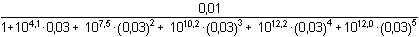 = == 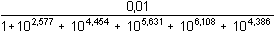 = 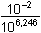 = 10 –8,246 mol·l –1 = 5,675·10–9 mol·l –1 Rovnovážné koncentrace komplexů, vztah (13):[Cu(NH3)2+] = 10–8,246·104,1·0,03 = 10–5,669 = 2,14·10–6 mol·l–1[Cu(NH3)22+] = 10–8,246·107,5·(0,03)2 = 10–3,792 = 1,61·10–4 mol·l–1 [Cu(NH3)32+]= 10–8,246·1010,2·(0,03)3 = 10–2,615 = 2,43·10–3 mol·l–1[Cu(NH3)42+]= 10–8,246·1012,2·(0,03)4 = 10–2,138 = 7,28·10–3 mol·l–1 [Cu(NH3)52+]= 10–8,246·1012,0·(0,03)5 = 10–3,860 = 1,38·10–4 mol·l–1 Ověření rovnovážné koncentrace ligandu:[NH3] = 0,08 – (2,14·10–6 + 2·1,61·10–4 + 3·2,43·10–3 + 4·7,28·10–3 + 5·1,38·10–4) == 0,08 – 0,037 = 0,043 mol·l–1 Rozdíl počáteční a výsledné rovnovážné koncentrace amoniaku je značný (43,3%). Další postup je aproximativní.Zpět
|
|




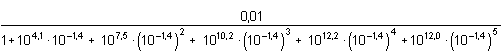 =
=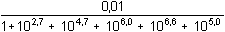 =
= 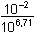 = 10–8,71 mol·l–1 = 1,95·10–9 mol·l–1
= 10–8,71 mol·l–1 = 1,95·10–9 mol·l–1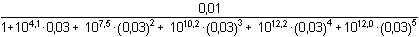 =
=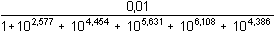 =
= 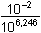 = 10–8,246 mol·l–1 = 5,675·10–9 mol·l–1
= 10–8,246 mol·l–1 = 5,675·10–9 mol·l–1