| |
| |
- Příklad 6.30




- Objem 10 ml 0,02M-KCN byl vytitrován 10 ml 0,01M-AgNO3. Jaké množství iontů CN- a Ag+ (pCN, pAg) není
v komplexu?
Řešení Argentometrickou titrací kyanidů vzniká komplex Ag(CN)2-; z toho vyplývá, žen(Ag+) = n(Ag(CN)2-) = n(CN–) · 1/210·0,01 = 10·0,02·1/2  bod ekvivalence Z upraveného vztahu (12) plyne pro [Ag+], resp. pro [CN–]:[Ag+] = 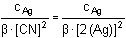  [Ag+] = [Ag+] = 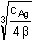 [Ag +] = 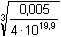 = 2,506·10 -8 mol·l -1 pAg = 7,60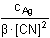  [CN-] = [CN-] = 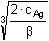 [CN -] = 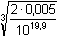 = 5,011·10 -8 mol·l -1 pCN = 7,30 Ověření správnosti: β = 0,005 / [(10–7,60)(10–7,30)2] = 1019,90Zpět
|
| | |
|
|




 bod ekvivalence
bod ekvivalence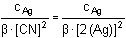
 [Ag+] =
[Ag+] = 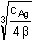
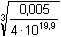 = 2,506·10-8 mol·l-1 pAg = 7,60
= 2,506·10-8 mol·l-1 pAg = 7,60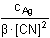
 [CN-] =
[CN-] = 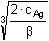
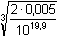 = 5,011·10-8 mol·l-1 pCN = 7,30
= 5,011·10-8 mol·l-1 pCN = 7,30