|
- Příklad 7.39




- K objemu 10 ml 0,1M-AgNO3 bylo přidáno 10 ml 0,1M-KCl a 480 ml vody. Vypočtěte,
jaké množství AgCl zůstalo v roztoku a jaké je ve sraženině?
Řešení Protože látková množství obou reagujících složek jsou stejná, rozpustnost produktu (AgCl) určuje součin rozpustnosti. Ks = 1,78·10–10 a) V roztoku je rozpuštěno (podle vztahu (7)):[AgCl] = 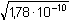 = 1,334·10–5 mol·l–1 = 1,334·10–5 mol·l–1 Hmotnost rozpuštěného AgCl v 500 ml:m(AgCl)rozp = 1,334·10–5 mol·l–1 · 143,32 g·mol–1 · 500/1000 = 9,56·10–4 g Teoretické množství AgCl vyplývá z látkového množství AgNO3:m(AgCl)teor =10 ml · 0,1 mmol/ml · 143,32 mg/mmol = 143,32 mg = 0,14332 g Procentový obsah rozpuštěného AgCl:w = 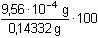 = 0,667 % = 0,667 % b) Množství AgCl ve sraženině: 0,14332 g – 9,56·10–4 g = 0,14236 gZpět
|
|




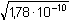 = 1,334·10–5 mol·l–1
= 1,334·10–5 mol·l–1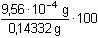 = 0,667 %
= 0,667 %