| |
| |
- Příklad 7.45




- K roztoku obsahujícímu chloridy a 0,1 mol·l-1 chromanů je po kapkách
přidáván roztok dusičnanu stříbrného. Při jaké látkové koncentraci chloridových iontů se začne
srážet chroman stříbrný? Jaké hmotnostní množství chloridů v objemu 0,1 litru zůstane v roztoku
nevysráženo?
Řešení Chloridy se budou srážet z roztoku jako AgCl tak dlouho, dokud se neustaví rovnováha[Ag+] = 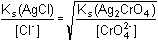 Pak musí platit rovnost poměrů koncentrací a součinů rozpustnosti: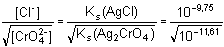 = 10–3,945 = 1,135·10–4 = 10–3,945 = 1,135·10–4[Cl –] = 1,135·10 –4· = 3,59·10–5 mol·l –1  1,27·10–4 1,27·10–4 g v 0,1 litru
Jiná varianta řešení vychází z předpokladu, že chloridy se budou srážet tak dlouho, dokud se v roztoku nevytvoří potřebná koncentrace Ag+-iontů pro vznik sraženiny Ag2CrO4. Ze součinu rozpustnosti AgCl pak podle (12b) a (10) vyplývá:[Cl–] = 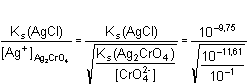 = 10–4,445 = 3,59·10–5 mol·l–1 = 10–4,445 = 3,59·10–5 mol·l–1 Zpět
|
| | |
|
|




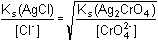
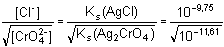 = 10–3,945 = 1,135·10–4
= 10–3,945 = 1,135·10–4 1,27·10–4 g v 0,1 litru
1,27·10–4 g v 0,1 litru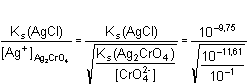 = 10–4,445 = 3,59·10–5 mol·l–1
= 10–4,445 = 3,59·10–5 mol·l–1