|
- Příklad 7.48




- Roztok olovnatých iontů (cPb = 0,001 mol·l-1) je srážen sulfanem
na PbS. Jaká musí být koncentrace sulfidu, aby došlo ke vzniku sraženiny a jaké bude pH v tomto
okamžiku, je-li roztok nasycen sulfanem
(c(H2S) = 0,1 mol·l-1)?
Řešení Nezbytnou koncentraci sulfidu pro vznik sraženiny PbS určuje součin rozpustnosti sloučeniny:Ks(PbS) = 10-26,6 = 2,51·10–27 Podle (12b): [S2–] > Ks(PbS) / c(Pb2+) > 2,51·10–27 / 0,001 = 2,51·10–24 mol·l–1Potřebnou koncentraci sulfidových iontů musí poskytnout sulfan rozpuštěný ve vodě, který jako kyselina disociuje ve dvou krocích. H2S + H2O  H3O+ + HS– K1 = [H3O+]·[HS–] / [H2S] = 10–7,07 H3O+ + HS– K1 = [H3O+]·[HS–] / [H2S] = 10–7,07HS – + H 2O  H 3O + + S 2– K 2 = [H 3O +]·[S 2–] / [HS –] = 10 –12,20
H2S + 2H2O  2H3O+ + S2– Kcelk = [H3O+]2·[S2–] / [H2S] = K1·K2 2H3O+ + S2– Kcelk = [H3O+]2·[S2–] / [H2S] = K1·K2 Z celkové disociační konstanty lze vypočítat nejnižší koncentraci H3O+-iontů (resp, pH), při které již dochází ke vzniku sraženiny PbS:[H3O+] = 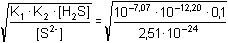 = 46,255 = 101,665 mol·l–1 = 46,255 = 101,665 mol·l–1 Za uvedených experimentálních podmínek (c(Pb2+) = 0,001 mol–1, c(H2S) = 0,1 mol·l–1) sulfid olovnatý bude vznikat při pH > –1,66.Zpět
|
|




 H3O+ + HS– K1 = [H3O+]·[HS–] / [H2S] = 10–7,07
H3O+ + HS– K1 = [H3O+]·[HS–] / [H2S] = 10–7,07 H3O+ + S2– K2 = [H3O+]·[S2–] / [HS–] = 10–12,20
H3O+ + S2– K2 = [H3O+]·[S2–] / [HS–] = 10–12,20 2H3O+ + S2– Kcelk = [H3O+]2·[S2–] / [H2S] = K1·K2
2H3O+ + S2– Kcelk = [H3O+]2·[S2–] / [H2S] = K1·K2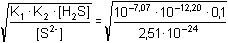 = 46,255 = 101,665 mol·l–1
= 46,255 = 101,665 mol·l–1