|
- Příklad 7.54




- Jaký objem 3,5%(m/m) BaCl2 (ρ = 1,000 g·cm-3) je třeba
na vysrážení síranů jako BaSO4, jestliže roztok obsahuje 0,3158 g
Al2(SO4)3·18H2O ? Jaký přebytek chloridu
barnatého uvedeného obsahu je nutno přidat do roztoku objemu 240 ml, aby ztráta BaSO4
nebyla větší než 5·10-5 g?
Řešení Pro vysrážení síranů je třeba ekvimolární množství BaCl2, vyplývající ze stechiometrie:Al2(SO4)3·18H2O → 3 SO42– → 3 BaSO4 → 3 BaCl2 Mr(Al2(SO4)3·18H2O) = 666,42; Mr(BaCl2) = 208,25a) Pomocí molárních hmotností korespondujících složek lze zjistit hmotnost (následně objem) BaCl2 potřebnou pro vysrážení síranových iontů z roztoku: m(BaCl2) = 0,3158 g 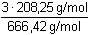 = 0,29606 g = 0,29606 gV 1 = 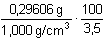 = 8,46 cm3 = ml 3,5 % BaCl 2 Sraženina BaSO4 je v nasyceném roztoku částečně rozpustná[BaSO4] = [Ba2+] = [SO42-] = 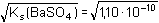 = 1,05·10–5 mol·l–1 = 1,05·10–5 mol·l–1 b) Ztráta BaSO4 však nesmí překročit hodnotu 5·10–5 g v 240 ml roztoku, resp. látkovou koncentraci[BaSO4] = 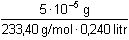 = 8,93·10–7 mol·l–1 = [SO42-] = 8,93·10–7 mol·l–1 = [SO42-] Pro tuto koncentraci síranu je třeba přídavek Ba2+-iontů, definovaný součinem rozpustnosti síranu barnatého (podle vztahu (10))[Ba2+] = [BaCl2] = 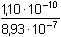 = 1,23·10–4 mol·l–1 = 1,23·10–4 mol·l–1 Vypočtená koncentrace představuje určitý objem V2 zředěného srážedla BaCl2 (ρ = 1,000 g·cm–3) v 1000 ml vzorku a v přepočtu na 240 ml:V2 = 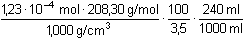 = 0,18 ml = 0,18 ml Zpět
|
|




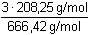 = 0,29606 g
= 0,29606 g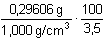 = 8,46 cm3 = ml 3,5 % BaCl2
= 8,46 cm3 = ml 3,5 % BaCl2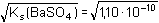 = 1,05·10–5 mol·l–1
= 1,05·10–5 mol·l–1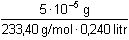 = 8,93·10–7 mol·l–1 = [SO42-]
= 8,93·10–7 mol·l–1 = [SO42-]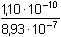 = 1,23·10–4 mol·l–1
= 1,23·10–4 mol·l–1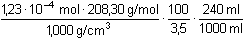 = 0,18 ml
= 0,18 ml