|
- Příklad 8.16




- Na základě rovnovážné konstanty rozhodněte o průběhu reakce
2 Fe 3+ + 3 I - 
2 Fe 2+ + I 3-
Řešení Rovnovážnou konstantu reakce 2 Fe3+ + 3 I-  2 Fe2+ + I3- lze vyjádřit vztahem 2 Fe2+ + I3- lze vyjádřit vztahemlog Kr = log 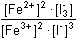 V rovnováze musí platit rovnost potenciálů obou systémů, tj. EFe3+/Fe2+ = EI3-/3I-E°Fe3+/Fe2+ + 0,059 log 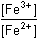 = E°I3-/3I- + = E°I3-/3I- +  log log 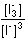 Matematickou úpravou rovnice lze získat výraz pro logaritmický tvar rovnovážné konstanty, odpovídající vztahu (13)log Kr = 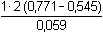 = 7,66 = 7,66  Kr = 4,58·107 Kr = 4,58·107 Hodnoty E° každého redoxního páru byly zjištěny z tabulek.Konstanta není dostatečně velká, reakce mezi ionty Fe3+ a I– pobíhá zvolna. Poznámka: Analogické je řešení pro reakci formulovanou 2 Fe3+ + 2 I–  2 Fe2+ + I2. 2 Fe2+ + I2. Hodnota konstanty je asi 2x větší (log Kr = 7,966; Kr = 9,25·107). Zpět
|
|




 2 Fe2+ + I3- lze vyjádřit vztahem
2 Fe2+ + I3- lze vyjádřit vztahem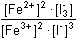
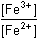 = E°I3-/3I- +
= E°I3-/3I- +  log
log 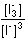
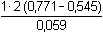 = 7,66
= 7,66  Kr = 4,58·107
Kr = 4,58·107 2 Fe2+ + I2.
2 Fe2+ + I2.