



Řešení Titrace probíhá podle následujícího schematu:
a) Přídavek manganistanu 2 ml:
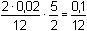 = 8,33·10–3 mmol·ml–1 = mol·l–1 = 8,33·10–3 mmol·ml–1 = mol·l–1[Sn2+] = E = 0,154 + 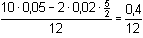 = 3,33·10–2 mmol·ml–1 = mol·l–1 = 3,33·10–2 mmol·ml–1 = mol·l–1 log log 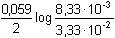 = 0,154 + 0,0295 log = 0,154 + 0,0295 log 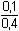 = 0,136 V = 0,136 VVýpočet je možný také pomocí ekvivalentového zlomku a, udávající poměrný obsah zreagovaného analytu vzhledem k jeho původnímu množství:
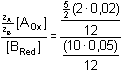 = 0,2 = 0,2[Sn2+]zbýv. = [Sn2+]pův. – [Sn2+]zreag = 1 – a = 0,8 Dosazením a a (1–a) do Petersovy rovnice se obdrží tentýž výsledek, E = 0,136 V b) Přídavek manganistanu 5 ml
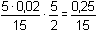 = 0,01667 mmol·ml–1 = mol·l–1 = 0,01667 mmol·ml–1 = mol·l–1[Sn2+] = E = E°Sn4+/Sn2+ = 0,154 V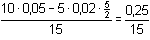 = 0,01667 mmol·ml–1 = mol·l–1 = 0,01667 mmol·ml–1 = mol·l–1nebo
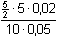 = 0,5 = 0,5  (1 – a) = 0,5 (1 – a) = 0,5  E = 0,154 V E = 0,154 V
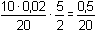 = 0,025 mmol·ml–1 = mol·l–1 = cSn2+ = 0,025 mmol·ml–1 = mol·l–1 = cSn2+[Sn2+] = 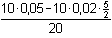 mmol·ml–1 mmol·ml–1  bod ekvivalence bod ekvivalencenebo
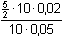 = 1 = 1  bod ekvivalence bod ekvivalenceVýpočet potenciálu podle vztahu (15):
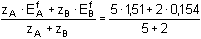 = 1,122 V = 1,122 V
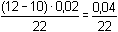 = 1,82·10-3 mmol·ml–1 = mol·l–1 = 1,82·10-3 mmol·ml–1 = mol·l–1[Mn2+] = E = 1,51 + 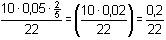 = 9,09·10-3 mmol·ml–1 = mol·l–1 = 9,09·10-3 mmol·ml–1 = mol·l–1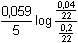 = 1,502 V = 1,502 Vnebo
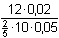 = 1,2 = 1,2  E = 1,51 + E = 1,51 + 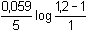 = 1,502 V = 1,502 V | ||