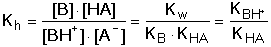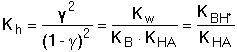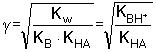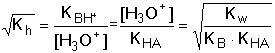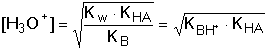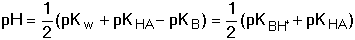| |||||
|
5.4.3. Soli slabé kyseliny a slabé zásady Při hydrolýze reagují s vodou oba ionty slabých protolytů: A- + H2O
 HA + OH-
HA + OH-BH+ + H2O
 B +
H3O+ B +
H3O+Sumární rovnici hydrolýzy BH+ + A- + 2 H2O
 B + HA + 2 H2O B + HA + 2 H2Opak odpovídá konstanta hydrolýzy: Protože platí[B] ≈ [HA] = cs · γ
[BH+] ≈ [A-] = cs(1 - γ)
Ze vztahů (64) a (67) vyplývá, že stupeň hydrolýzy a pH roztoku závisí na hodnotě disociačních konstant, nikoliv na látkové koncentraci sloučeniny. Řešený příklad:
| ||
| |||||