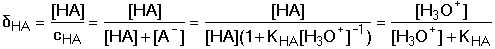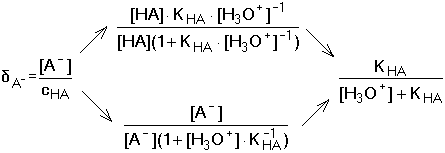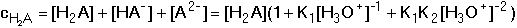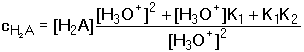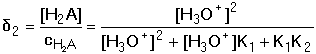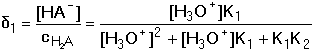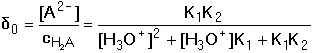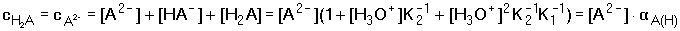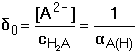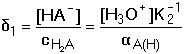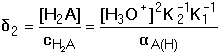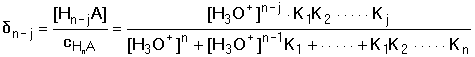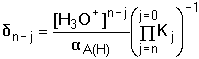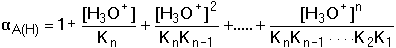| |||||
|
5.8. Grafické znázorňování protolytických rovnováh Rovnovážné složení protolytického systému lze vyjádřit graficky. Graf je názorný, umožňuje rozlišit převažující a zanedbatelné součásti systému v daných experimentálních podmínkách, a tím zjednodušit výpočty. Znázorňují závislost poměrného zastoupení součástí rovnovážného systému na proměnné řídící veličině, kterou v případě acidobazických rovnováh je pH. Diagramy jsou tvořeny distribučními křivkami δi = f(pH), kde distribuční koeficient δi je nepojmenované číslo (někdy udávaný v procentech). A. Jednosytné slabé kyseliny Frakce kyseliny je určena distribučním koeficientem δHA: Frakce konjugované zásady δA:
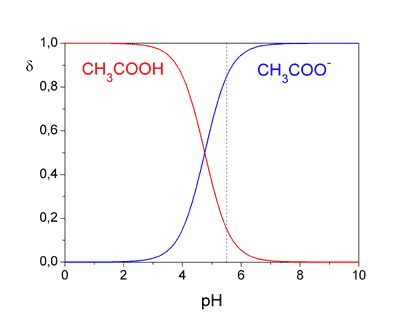
Obr. 1. Distribuční diagram systému kyseliny octové (pHHAc = 4,755) Při pH vně intervalu (pKHA – 2) ≤ pH ≤ (pKHA + 2) je v roztoku přítomna pouze jedna acidobazická forma systému. Průsečík křivek při δi = 0,5 vypovídá, že v tomto bodě pH = pKHA. Koncentrace jednotlivých složek při určitém pH se podle (88) a (89) vypočítají jako součin distribučního koeficientu a celkové koncentrace kyseliny ([HiA] = δi · cHA). B. Dvojsytné (vícesytné) kyseliny U dvojsytné kyseliny probíhají podle acidity dvě rovnováhy: H2A + H2O
 H3O+ + HA- K1 =
[H3O+][HA-]/[H2A]
H3O+ + HA- K1 =
[H3O+][HA-]/[H2A]HA- + H2O
 H3O+ + A2- K2 =
[H3O+][A2-]/[HA-]
H3O+ + A2- K2 =
[H3O+][A2-]/[HA-]Celková koncentrace kyseliny:
Frakce jednotlivých složek systému: Distribuční koeficienty lze také vypočítat pomocí koeficientu protonizace αA(H) konjugované báze:
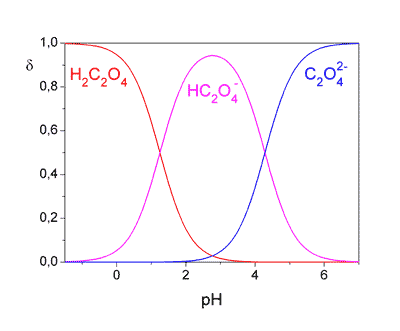
Obr. 2. Distribuční diagram složek systému kyseliny šťavelové Pro vyjádření distribuce komponent systému obecně vícesytné kyseliny HnA lze použít následující vztahy: pro j = 0 až nresp. kde
Je-li poměr dvou sousedních disociačních konstant Kj/Kj+1 ≥ 104 (pKj+1 – pKj ≥ 4), jednotlivé disociační rovnováhy se vzájemně neovlivňují a lze je posuzovat izolovaně. Při pH vně intervalu (pKj – 2) ≤ pH ≤ (pKj + 2) se v roztoku nachází pouze jedna protolytická forma (δi = 1). | ||
| |||||