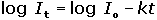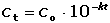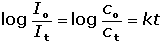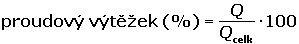| |||||
|
Coulometrické metody analýzy jsou založeny na úplné elektrolýze analytu. Předpokládá se, že analyt je na pracovní elektrodě kvantitativně (100 %) zredukován či zoxidován nebo zcela zreagoval s činidlem vygenerovaným na elektrodě. Podle Faradayova zákona je látkové množství (resp. hmotnost m) analytu zreagovaného na elektrodě úměrná elektrickému náboji Q, tedy době elektrolýzy t a prošlému proudu I: kde z je počet elektronů vyměněných při redoxní reakci analytu a F Faradayova konstanta (96485,34 C·mol-1). Je-li při elektrolýze udržován konstantní potenciál pracovní elektrody, proud s časem exponenciálně klesá: spotřebovaný náboj je určen plochou pod I – t křivkou, tzn. Integrací v mezích od 0 do ∞ se získá údaj teoretického množství náboje potřebného ke kvantitativnímu (100 %) průběhu reakce látky na elektrodě kde k, resp. κ je koeficient přenosu hmoty, jeho rozměr je [s–1]. Hodnoty Io a k lze zjistit z logaritmického tvaru exponenciální rovnice (VI.2) která v grafickém vyjádření představuje přímku s úsekem log Io a směrnicí k. Protože limitní proud je přímo úměrný koncentraci, lze odvodit analogický vztah pro okamžitou koncentraci analytu Úpravou obou rovnic (VI.2) a (VI.6) se obdrží vztah Za předpokladu známé hodnoty koeficientu k lze zjistit dobu potřebnou k poklesu původní koncentrace co na koncentraci ct. V případě poklesu o jeden řád: t = 1/k. Obecně pokles o x řádů: t = x/k Proudový výtěžek jedné reakce je dán poměrem mezi nábojem Q spotřebovaným na tuto reakci a celkovým nábojem Qcelk prošlým článkem: | ||
| |||||

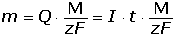
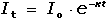
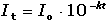 (VI.2)
(VI.2)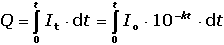
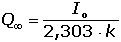
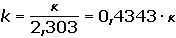 (VI.4)
(VI.4)