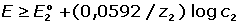|
V.2. Selektivní elektrolýza
Pro selektivní a zároveň kvantitativní vyloučení kovu ze směsi dvou iontů je však třeba potenciál pracovní
elektrody nastavit na takovou hodnotu, aby koncentrace kovu s positivnějším potenciálem byla na konci
elektrolýzy zanedbatelně malá vzhledem k počáteční koncentraci c1, přičemž druhý kov
(s negativnějším potenciálem redukce) se nesmí vylučovat. Má-li být na elektrodě vyloučeno 99,99 % kovu
(v roztoku zůstává 10-4 c1), musí být pro potenciál elektrody splněny
následující podmínky:
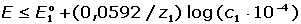
 E musí být negativnější než
E1 (V.5) E musí být negativnější než
E1 (V.5)
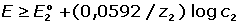
 E musí být positivnější než
E2 (V.6) E musí být positivnější než
E2 (V.6)
Příklady
- Příklad V.2.1




- Z roztoku směsi 0,1M-Ag+ a 0,1M-Cu2+-iontů má být elektrolyticky odděleno stříbro
při t = 25 °C. a) Jaký je rovnovážný potenciál stříbrné elektrody (vztažený k vodíkové
elektrodě) na počátku (E1) a na konci elektrolýzy (E2),
provedené z 99,99 % ? b) V jakých mezích je nutno udržovat potenciál katody Ek,
aby nedošlo k vyloučení mědi?
- Příklad V.2.2




- Roztok obsahuje Ag+-ionty a 0,001M-Cu2+. Jaká by měla být koncentrace stříbrných
iontů (při zanedbání přepětí), aby se při elektrolýze vylučovalo stříbro současně s mědí?
(t = 25 °C)
- Příklad V.2.3




- Roztok obsahuje Au3+-ionty a 0,01M-Ag+. Jaká by měla být koncentrace zlatitých
iontů (při zanedbání přepětí), aby se oba kovy začaly vylučovat současně?
- Příklad V.2.4




- Roztok ZnSO4 v 0,1M-H2SO4 je elektrolyzován na Hg-katodě, jejíž
potenciál je udržován na hodnotě –0,90 V. a) Jaká je konečná koncentrace Zn2+-iontů
v roztoku, b) může vyvíjející se vodík rušit elektrolýzu Zn2+-iontů? Standardní potenciál
reakce Zn2+ + 2e = Zn(Hg) je –0,752 V, a ≈ c, přepětí vodíku na rtuti
ηH = –0,89 V, atmosférický tlak p = 105,6 kPa, tenze vodní
páry pH2O = 4,27 kPa, t = 25 °C.
- Příklad V.2.5




- Měděná elektroda má v roztoku 0,1M-Cu2+-iontů potenciál 0,307 V a kadmiová v roztoku
0,1M-Cd2+-iontů –0,43 V. V roztoku 0,4M-KCN poklesne potenciál Cu-elektrody na –0,970 V
a Cd-elektrody na
–0,892 V proti SVE; t = 25 °C.
- a) Lze kvantitativně vyloučit Cu vedle Cd za nepřítomnosti KCN ?
- b) Který kov se vyloučí v 0,4M-KCN dříve?
- c) Jaká koncentrace Cd2+ zůstane v roztoku po elektrolýze z 0,4M-KCN, je-li potenciál
katody –0,980 V a Cd2+-ionty jsou vázány jako [Cd(CN)4]2- ?
Koncentrace CN- se během elektrolýzy nemění.
|
|

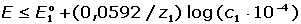
 E musí být negativnější než
E1 (V.5)
E musí být negativnější než
E1 (V.5)