



Řešenía) Koncentrace Zn2+-iontů v roztoku při Ek = –0,90 V (podle rov. IV.2): EoZn2+/Zn(Hg) = -0,752 V Ek = –0,90 = –0,752 + 0,0296 log [Zn2+] log [Zn2+] = -5,0 b) Potenciál vzniku vodíku: 0,1M-H2SO4 → 0,2M-H+ Podle vztahu (IV.3): EH = Eo2H+/H2 + EH = 0,0 + 0,0592 log 0,2 – 0,0296 log Celkový elektrodový potenciál pro počátek vývoje vodíku: Ep = EH + ηH = –0,041 + (–0,89) = –0,931 V < Ek Nastavený pracovní potenciál Hg-katody (Ek = –0,90) je positivnější oproti Ep = –0,931 V | ||
 [Zn2+] =
[Zn2+] = 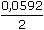 log
log 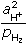
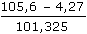 = –0,041 V
= –0,041 V