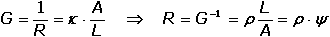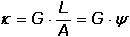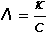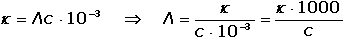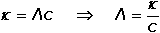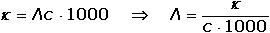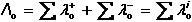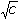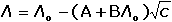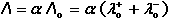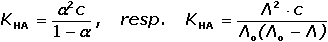| |||||
|
Vodivost (konduktance) G – převrácená hodnota odporu (resistance) R, jednotkou je siemens (S = Ω–1). Odpor mezi elektrodami je nepřímo úměrný koncentraci iontů, je tedy z analytického hlediska výhodnější měřit vodivost G: kde ρ je měrný odpor (rezistivita) [Ω·cm], A a L – plocha elektrod [cm2] a jejich vzájemná vzdálenost [cm], κ - specifická vodivost (konduktivita) [S·cm-1], ψ je odporová konstanta nádobky [cm-1]. Elektrickou vodivost určitého materiálu charakterizuje specifická (měrná) vodivost (konduktivita) κ, která je vztažena na jednotku plochy A a jednotku délky L vodiče; základní rozměr konduktivity je S·m–1. K určení měrné vodivosti analyzovaného roztoku na základě změřené vodivosti musí být známa hodnota odporové konstanty nádobky. Ve většině případů ji nelze určit z geometrických rozměrů. Proto se nádobka kalibruje měřením vodivosti standardního roztoku (např. KCl) o známé konduktivitě (při určité teplotě) a konstanta ψ se vypočítá z rovnice Je-li v roztoku jediný elektrolyt o koncentraci c, pak podíl měrné vodivosti tohoto roztoku a koncentrace je molární vodivost Λ Vztáhneme-li specifickou vodivost ke krychli o hraně 1 cm, resp. 1 dm, resp. 1 m, pak platí kde rozměr konduktivity κ je [S·cm-1] (a), [S·dm-1] (b), resp. [S·m-1] (c) a koncentrace c [mol·dm-3]. U vícemocných iontů jsou někdy uváděny hodnoty tzv. ekvivalentové iontové vodivosti, což je molární vodivost iontů vztažená na jednotkový náboj: Λekv = Λ / |z|. Molární vodivost (Λ) je závislá na koncentraci elektrolytu a její maximální hodnota, zjištěná extrapolací k nulové koncentraci, se nazývá molární vodivost při nekonečném zředění (Λo). Tato veličina je charakteristickou konstantou pro danou látku a je rovna součtu iontových vodivostí při nekonečném zředění jednotlivých iontů v roztoku: Molární vodivost (Λ) určitého elektrolytu závisí na jeho látkové koncentraci. U silných elektrolytů, kde se uplatňuje vliv vzájemné interakce iontů, závislost molární vodivosti na koncentraci (při c < 10–3 mol·l–1) vystihuje Debey-Hückel-Onsagerova rovnice Λ = Λo - a kde a je empirická konstanta, pro uni-univalentní elektrolyt má tvar a = A + BΛo. V tomto případě závislost vystihuje rovnice kde konstanta A = 60,65 a B = 0,230. Závislost molární vodivosti na koncentraci je značná u slabých elektrolytů, u nichž platí Stupně disociace (α = Λ /Λo) lze využít k výpočtu disociační konstanty slabé kyseliny, resp. báze (Ostwaldův zřeďovací zákon): | ||
| |||||