



ŘešeníHodnoty potenciálů z tab.1: EoO2/H2O = 1,229 V, EoCu2+/Cu = 0,337 V a) Rovnovážný potenciál anody je určován reakcí: O2 + 4 H+ + 4 e Ea = EoO2/H2O + Protože atmosférický tlak je 101,325 kPa a koncentrace silné kyseliny je 1 mol/l, rovnice se zjednoduší na tvar Ea = 1,229 + 0,0148 log (1)4 = 1,229 V Rovnovážný potenciál katody (podle rov. IV.2): Ek = EoCu2+/Cu + Rozkladné napětí (rov. V.4): Ur = 1,229 + 0,42 – 0,337 – 0,00 = 1,312 V b) Rovnovážný potenciál anody a katody v pufru o pH 4: Ea = 1,229 + Ek = 0,337 + Rozkladné napětí (rov. V.4): Ur = 0,992 + 0,42 – 0,337 – 0,00 = 1,075 V | ||
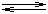 2 H2O
2 H2O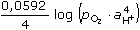
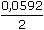 log aCu2+ = 0,337 + 0,0296 · log 1 = 0,337 V
log aCu2+ = 0,337 + 0,0296 · log 1 = 0,337 V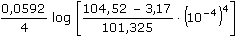 = 1,229 + (–0,237) = 0,992 V
= 1,229 + (–0,237) = 0,992 V