



ŘešeníParciální tlak CO2 ve vzduchu: p = Koncentrace CO2 ve vodě za uvedeného tlaku (podle Henryho zákona): cCO2 = 0,0338 · Na specifické vodivosti roztoku se budou podílet ionty H+, HCO3-, CO32-, a OH–. Při výpočtu koncentrace iontů (tvořící vodivost) vzniklých disociací slabé kyseliny uhličité je možno uvažovat pouze disociaci do 1. stupně. Hodnotu pH roztoku vypočítáme běžným způsobem z konstanty pH = ½(6,352 – log 1,014·10–5) = 5,67 Protože pH < 1,3 – log c(H2CO3), tzn. [H2CO3] ≠ c(H2CO3), koncentraci H+-iontů je třeba upřesnit podle kvadratické rovnice [H+]2 + [H+]K1 – K1c = 0. Z této rovnice vyplývá, že [H+] = 1,91·10–6 mol·l–1 = [HCO3- ] a [OH–] ~ 5,23·10–9 mol·l–1. Protože [OH–] je asi o 3 řády menší než [H+], lze předpokládat, že na vodivosti roztoku se budou podílet především ionty H+ a HCO3–. Specifickou vodivost pak vypočítáme pomocí vztahu (VIII.4a): κ = | ||
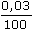 · 101,325 = 0,0304 kPa
· 101,325 = 0,0304 kPa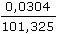 = 1,014·10–5 mol·l–1 = c(H2CO3)
= 1,014·10–5 mol·l–1 = c(H2CO3)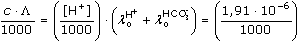 · (349,8 + 44,50) =
· (349,8 + 44,50) =