|
- Příklad VIII.1.24




- Molární vodivost roztoku 0,1M-CH3COOH při 18 °C je ΛHAc = 4,6
S·cm2·mol–1, vodivost roztoku 0,001M-CH3COONa při téže
teplotě je 75,2 S·cm2·mol–1. Jakou hodnotu má disociační konstanta
kyseliny KHAc?
λo(Na+) = 43,5 S·cm2·mol–1,
λo(H+) = 316 S·cm2mol–1 (18 °C)
ŘešeníVýpočet molární vodivosti kyseliny: Λo(HAc) Λo(HAc) = λo(H+) + λo(Ac-) λo(Ac-) = Λo(NaAc) - λo(Na+) = 75,2 – 43,5 = 31,7 S·cm2·mol–1 Λo(HAc) = 316 + 31,7 = 347,7 S·cm2·mol–1 Výpočet disociační konstanty (VIII.8): KHAc = 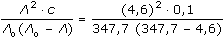 = 1,774·10-5 = 1,774·10-5  pKHAc = 4,75 pKHAc = 4,75 Výpočet konstanty pomocí stupně disociace: α = Λ / Λo = 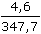 = 0,01323 = 0,01323 KHAc = 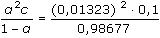 = 1,77·10-5 = 1,77·10-5 Zpět
|
|




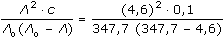 =
=  pKHAc = 4,75
pKHAc = 4,75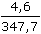 = 0,01323
= 0,01323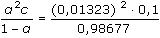 =
=