| |
| |
- Příklad 3.31




- Zásobní roztok 500 ml obsahoval 15,00 g směsi HNO3 a H2SO4.
Při titraci 25,00 ml tohoto roztoku se spotřebovalo 34,28 ml 0,1989M-NaOH. Z podílu
50,00 ml byl po redukci vzniklý amoniak předestilován do 50,00 ml
0,1322M-H2SO4 a její nezreagovaný přebytek byl retitrován
23,83 ml 0,1989M-NaOH. Jaký je hmotnostní obsah jednotlivých kyselin ve směsi?
Řešení Kyselina dusičná je stanovena na základě redukce na amoniak, n(HNO3) = n(NH3); postup výpočtu podle
(3), resp. příkl. 3.7.wHNO3 = 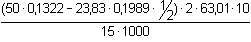 = 0,3563, tj. 35,63 % = 0,3563, tj. 35,63 % a) Látkové množství NaOH na kyselinu sírovou představuje rozdíl celkové spotřeby hydroxidu a spotřeby na HNO3 v polovičním objemu vzorku:wH2SO4 = 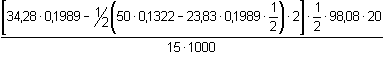 = 0,1686, tj. 16,86 % = 0,1686, tj. 16,86 % b) Protože n(HNO3) = n(NaOH), lze vypočítat objem spotřebovaného hydroxidu na kyselinu dusičnou v 25 ml vzorku. Další výpočet bude podle základního vztahu (3).n(HNO3) = 1/2 (50 · 0,1322 - 23,83 · 0,1989 · 1/2) · 2 = 4,240 mmolV NaOH · 0,1989 = 4,24 · 1  V NaOH = 21,32 ml 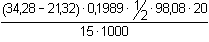 = 0,1686, tj. 16,86 % = 0,1686, tj. 16,86 % Zpět
|
| | |
|
|




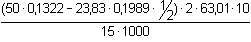 = 0,3563, tj. 35,63 %
= 0,3563, tj. 35,63 %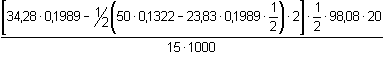 = 0,1686, tj. 16,86 %
= 0,1686, tj. 16,86 % VNaOH = 21,32 ml
VNaOH = 21,32 ml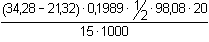 = 0,1686, tj. 16,86 %
= 0,1686, tj. 16,86 %