



Řešení Disociační konstanty kyseliny vinné:
 K1 = 9,204·10-4 K1 = 9,204·10-4pK2 = 4,366  K2 = 4,305·10-5 K2 = 4,305·10-5
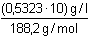 = 0,0283 mol·l–1 = 0,0283 mol·l–1a) [H3O+] = pH = 3,71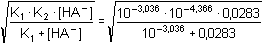 = 1,959·10-4 mol·l–1 = 1,959·10-4 mol·l–1 Podle vztahu (73): pH = 1/2(3,036 + 4,366) = 3,70 b) Vliv iontové síly roztoku na hodnotu pH: I = 0,0283 Podle (23):
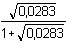 = 3,036 – 0,144 = 2,892 = 3,036 – 0,144 = 2,892pK2,c = 4,366 – 2 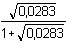 = 4,366 – 0,288 = 4,078 = 4,366 – 0,288 = 4,078
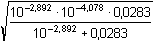 = 3,20·10–4 mol·l–1 = 3,20·10–4 mol·l–1pH = 3,50
 = 7,075·10–3 mol·l–1 = 7,075·10–3 mol·l–1[A2–] = K2 [HA–]/[H3O+] = [H2A] + [A2–] = 0,0145 > 0,05 · 0,0283 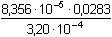 = 7,390·10–3 mol·l–1 = 7,390·10–3 mol·l–1 třeba upřesnit aproximací třeba upřesnit aproximacíUpřesnění na základě zjištění nové rovnovážné koncentrace HA– podle vztahu (68):
[HA–] = 0,0283 – (7,075·10–3 + 7,390·10–3) = 0,0138 mol·l–1
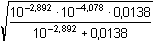 = 3,13·10–4 mol·l–1 pH = 3,50 = 3,13·10–4 mol·l–1 pH = 3,50 | ||