



Řešení Základní tvar rovnice pro výpočet pH kyselého pufru (76): pH = pKHA + log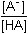 a) pH = 4,756 + log (0,05 / 0,1) = 4,456 ≈ 4,45 Iontovou sílu roztoku tvoří octan sodný: I = 0,05
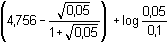 = 4,27 = 4,27b) Přídavkem silné kyseliny se změní poměr kyseliny octové a její konjugované báze. Iontovou sílu roztoku zbývající octan, ionty Na+ a Cl–: I = 0,05
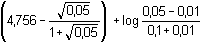 = 4,13 = 4,13Bez respektování iontové síly roztoku je pH = 4,32 c) Přídavkem silné zásady přibude ekvivalentní množství octanu. Iontovou sílu roztoku tvoří celková koncentrace octanu, ionty Na+ a K+: I = 0,10
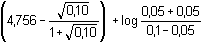 = 4,82 = 4,82 | ||