|
- Příklad 5.138




- Jaké hodnoty pH bude mít roztok 100 ml 0,1 molární kyseliny citronové po přídavku:
a) 100 ml 0,1M-NaOH,
b) 150 ml 0,1M-NaOH,
c) 280 ml 0,1M-NaOH ?
Řešení Tři přídavky alkalického hydroxidu mohou představovat tři body titrace trojsytné slabé kyseliny. a) Přídavek 100 ml 0,1M-NaOH ke 100 ml 0,1 molární kyseliny citrónové:n(NaOH) : n(H3A) = 1:1  produktem je amfolyt H2A– produktem je amfolyt H2A– c(H2A–) = 0,05 mol·l–1 c(H2A–) > K1  pro výpočet pH lze tedy použít jednoduchý vztah (73) pro výpočet pH lze tedy použít jednoduchý vztah (73)pH = 1/2(pK1 + pK2) = 1/2(3,128 + 4,761) = 3,94 Vliv iontové síly roztoku (ionty Na+ a H2A–): I = 0,05pH = 1/2[(3,128 – 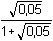 ) + (4,761 – 2 · ) + (4,761 – 2 · 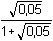 )] = 3,67 )] = 3,67 b) Přídavek 150 ml 0,1M-NaOH ke 100 ml 0,1 molární kyseliny citrónové: Objem 50 ml NaOH způsobí částečnou neutralizaci amfolytu H2A–.[H2A–] = 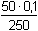 = 0,02 mmol·ml–1 = mol·l–1 = 0,02 mmol·ml–1 = mol·l–1[H2A–] = 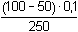 = 0,02 mmol·ml–1 = mol·l–1 = 0,02 mmol·ml–1 = mol·l–1 Protože koncentrace (látková množství) obou aniontů jsou stejné, podle (76)pH = pK2 = 4,76 Iontová síla roztoku (ionty Na+, H2A– a HA2–): I = 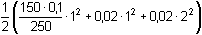 = 0,08 = 0,08pH = 4,76 – 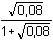 = 4,32 c) Přídavek 280 ml 0,1M-NaOH ke 100 ml 0,1 molární kyseliny citrónové:Objem 80 ml NaOH způsobí částečnou neutralizaci amfolytu HA2–.[A3–] = 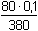 = 0,0210 mmol·ml–1 = mol·l–1 = 0,0210 mmol·ml–1 = mol·l–1[HA2–] = 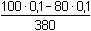 = 5,26·10-3 mmol·ml–1 = mol·l–1 = 5,26·10-3 mmol·ml–1 = mol·l–1 Podle vztahu (76):pH = pK3 + log 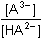 = 6,396 + log = 6,396 + log 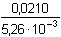 = 6,997 ≈ 7,00 = 6,997 ≈ 7,00 Iontová síla roztoku (ionty Na+, HA2- a A3-):I = 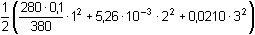 = 0,142 = 0,142pH = 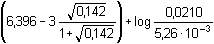 = 6,176 ≈ 6,18 Zpět
|
|




 produktem je amfolyt H2A–
produktem je amfolyt H2A–  pro výpočet pH lze tedy použít jednoduchý vztah (73)
pro výpočet pH lze tedy použít jednoduchý vztah (73)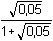 ) + (4,761 – 2 ·
) + (4,761 – 2 · 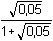 )] = 3,67
)] = 3,67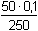 = 0,02 mmol·ml–1 = mol·l–1
= 0,02 mmol·ml–1 = mol·l–1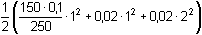 = 0,08
= 0,08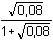 = 4,32
= 4,32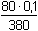 = 0,0210 mmol·ml–1 = mol·l–1
= 0,0210 mmol·ml–1 = mol·l–1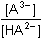 = 6,396 + log
= 6,396 + log 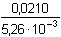 = 6,997 ≈ 7,00
= 6,997 ≈ 7,00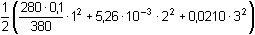 = 0,142
= 0,142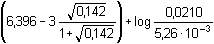 = 6,176 ≈ 6,18
= 6,176 ≈ 6,18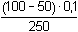 = 0,02 mmol·ml–1 = mol·l–1
= 0,02 mmol·ml–1 = mol·l–1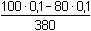 = 5,26·10-3 mmol·ml–1 = mol·l–1
= 5,26·10-3 mmol·ml–1 = mol·l–1