Řešení: a) pH na počátku titrace - roztok obsahuje pouze kyselinu octovou, výpočet provedeme podle vztahu (31b):
b) pH před bodem ekvivalence - roztok obsahuje směs kyseliny octové a octanu, výpočet provedeme podle vztahu (76): Po přídavku 1 ml 0,1M-NaOH
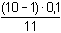
[Ac-] =
pH = 4,75 + log 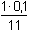 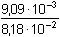 =
3,80 =
3,80
Po přídavku 5 ml 0,1M-NaOH je zneutralizována polovina původní koncentrace kyseliny octové,
tedy platí
c) pH v bodě ekvivalence (pT) - roztok obsahuje pouze octan sodný, výpočet podle vztahu (55):
pH = 1/2(14 + 4,75 + log 0,05) = 8,72
d) pH za bodem ekvivalence - roztok obsahuje octan a nadbytek hydroxidu sodného. Zanedbáme-li hydrolýzu aniontu, bude [NaOH] = [OH-] Po přídavku 11 ml 0,1M-NaOH:
pH = 14 – 2,32 = 11,68
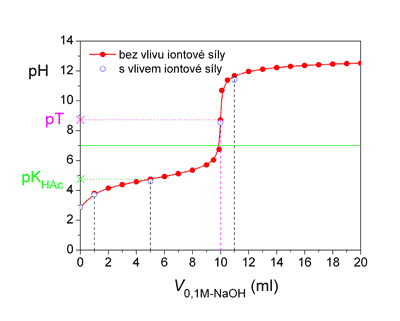
Pro získání přesnějších hodnot pH je třeba uvažovat vliv iontové síly roztoku v jednotlivých fázích titrace (pH = 2,88; 3,71; 4,60; 8,54; 11,39)
Titrační křivka pro titraci 10 ml 0,1M-CH3COOH odměrným roztokem 0,1M-NaOH.
Přídavky 1 ml, 5 ml, 10 ml a 11 ml titračního činidla jsou vyznačeny čárkovanou svislou čárou.
| ||