Řešení: a) pH roztoku na začátku titrace - v roztoku je pouze slabá zásada. Podle vztahu (36)
Výpočet pH podle podmínky pOH > 1,30 – log cB je dostatečně správný.
b) pH roztoku před bodem ekvivalence - roztok obsahuje směs hydroxidu a chloridu amonného, výpočet provedeme podle vztahu (79). Po přídavku 1 ml 0,1M-HCl:
[NH4+] = 1·0,1/11 = 0,00903 mol·l-1
pH = 14 – (4,76 + log 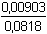 ) = 14 – 3,80 =
10,20 ) = 14 – 3,80 =
10,20
Po přídavku 5 ml 0,1M-HCl je zneutralizována polovina původní koncentrace hydroxidu amonného, a tedy platí
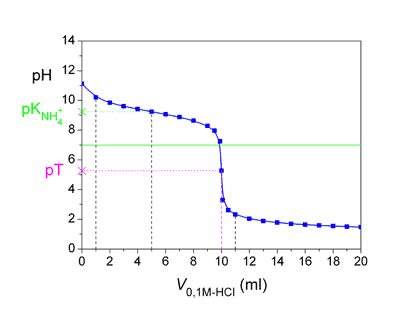
 pH = pKNH4+
pH = pKNH4+
pH = 14 – 4,76 = 9,24
c) pH roztoku v bodě ekvivalence (pT) - roztok obsahuje pouze chlorid amonný, výpočet se provede podle vztahu (61):
pH = 1/2(14 – 4,76 – log 0,05) = 5,27
resp. pH = 1/2(9,24 – log 0,05) = 5,27
d) pH roztoku za bodem ekvivalence - roztok obsahuje chlorid amonný a přebytek kyseliny chlorovodíkové. Zanedbáme-li hydrolýzu amonia, bude [H3O+] = [HCl]. Po přídavku 11 ml 0,1M-HCl:
Vliv iontové síly roztoku se na hodnotě pH projeví až za bodem ekvivalence:
Titrační křivka pro titraci 10 ml 0,1M-NH4OH odměrným roztokem 0,1M-HCl.
Přídavky 1 ml, 5 ml, 10 ml a 11 ml titračního činidla jsou vyznačeny čárkovanou svislou čárou.
| ||