|
- Příklad 5.23




- Jaké je pH roztoku vzniklého zneutralizováním 0,002 molární kyseliny dusičné roztokem
0,01M-KOH na 99,99% ? Uvažujte také vliv iontové síly!
Řešení Kyselina dusičná je zneutralizována z 99,99%, tzn. že v roztoku zbývá pouze 0,01% původního množství.Bylo-li v litru roztoku původně 0,002 mol HNO3, pak 0,01% představuje množství n(HNO3) = 0,002 · 0,01/100 = 2·10–7 mol Změna objemu vlivem přídavku 0,01M-KOH:Vcelk. = Vkys + Vzás = Vkys + Vkys/5 = 1,20 Vkys Látková koncentrace zbývajících H+-iontů a pH:c(H+) = 2·10-7/1,20 = 1,667·10–7 mol·l–1  pH = 6,78 pH = 6,78 Iontovou sílu roztoku budou tvořit K+ a NO3–-ionty:I = 0,5 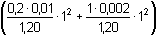 = 1,667·10–3 = 1,667·10–3 Aktivitní koeficient (podle rovnice (10)):- log fH+ = 0,509 · 12 · 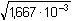 = 0,0208 = 0,0208  fH+ = 0,953 fH+ = 0,953 Aktivita H+-iontu a korigované pH:a(H+) = 1,667·10–7 · 0,953 = 1,589·10–7 mol·l–1  pH = 6,80 pH = 6,80 Zpět
|
|




 pH = 6,78
pH = 6,78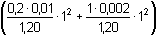 = 1,667·10–3
= 1,667·10–3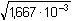 = 0,0208
= 0,0208  fH+ = 0,953
fH+ = 0,953 pH = 6,80
pH = 6,80