| |
| |
- Příklad 5.30




- Ke 200 ml 0,05M-HCl bylo přidáno 0,5 g NaOH. Vypočtěte pH za předpokladu, že hydroxid sodný
byl čistý (100%) a že jeho přídavkem nenastala objemová změna! Příklad počítejte jednak
s koncentrací, jednak s aktivitou.
Řešení Koncentrace NaOH přidaného do objemu 200 ml kyseliny:c(NaOH) =  = 0,0625 mol·l–1 = 0,0625 mol·l–1 Koncentrace nadbytečných OH–-iontů po reakci s HCl:(200 · 0,0625) – (200 · 0,05) = 200 · c(OH–)n(OH–) n(H+) n(OH–)přeb. c(OH–) = 0,0125 mmol·ml–1 = mol·l–1  pOH = 1,90 ..... pH = 12,10 pOH = 1,90 ..... pH = 12,10 Iontová síla roztoku je tvořena ionty OH–, Na+ a Cl– (7) :I = 1/2(0,0125·12 + 0,0625·12 + 0,05·12) = 0,0625 Výpočet aktivitního koeficientu podle (9):–log fOH- = 0,509·12·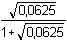 = 0,509 · 0,20 = 0,1018 = 0,509 · 0,20 = 0,1018  fOH- = 0,791 fOH- = 0,791 Výpočet pH: aOH- = 0,0125·0,791 = 9,888·10–3 mol·l–1  pOH = 2,00 pOH = 2,00Podle (3) a (20): pH = (14,00 – 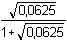 ) – 2,00 = 11,80Zpět
|
| | |
|
|




 = 0,0625 mol·l–1
= 0,0625 mol·l–1 pOH = 1,90 ..... pH = 12,10
pOH = 1,90 ..... pH = 12,10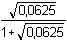 = 0,509 · 0,20 = 0,1018
= 0,509 · 0,20 = 0,1018  fOH- = 0,791
fOH- = 0,791 pOH = 2,00
pOH = 2,00