| |
| |
- Příklad 5.56




- Slabá jednosytná kyselina HA je při koncentraci 0,1 mol·l-1 disociována
na 5 %. Jaké bude pH roztoku této kyseliny při koncentraci 0,05 mol·l-1?
Řešení K výpočtu pH roztoku 0,05 molární kyseliny je třeba znát hodnotu disociační konstanty slabé kyseliny. Použijeme vztah (33).KHA = 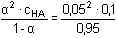 = 2,63·10–4 pKHA = 3,58 = 2,63·10–4 pKHA = 3,58 Podle (31b):pH = 1/2(pKHA – log cHA) = 1/2(3,58 – log 0,05) = 2,44podmínka správnosti: 2,44 < 1,30 – log 0,05 = 2,60 Upřesnění podle (30):[H+]2 + 2,63·10–4 [H+] – 2,63·10–4 · 0,05 = 0kladný kořen rovnice: [H+] = 3,497·10–3 mol·l–1, pH = 2,46 Zpět
|
| | |
|
|




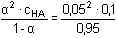 = 2,63·10–4 pKHA = 3,58
= 2,63·10–4 pKHA = 3,58