| |
| |
- Příklad 5.64




- V 1,5%(m/m) roztoku hydroxylaminu disociuje tato zásada na 0,015 %. Vypočtěte konstantu
KB a pH roztoku!
Řešení Základní reakční schéma: B + H2O  BH+ + OH– BH+ + OH–Celková koncentrace hydroxylaminu: c B = 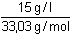 = 0,4541 mol·l –1[OH-] = [BH+] = α · cB = 0,00015 · 0,4541 = 6,81·10–5 mol·l–1[B] = (1–α)·cB = 0,99985 · 0,4541 = 0,4540 mol·l–1 Výpočet konstanty basicity KB se vypočítá dosazením rovnovážných koncentrací do definičního tvaru konstanty nebo lze využít analogického vztahu jako u kyselin (33):KB = 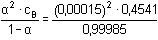 = 1,022·10–8 = 10-7,99 = 1,022·10–8 = 10-7,99 Hodnotu pH lze vypočítat pomocí disociačního stupně (39):pH = pKw + log (cB · α) = 14 + log (0,4541 · 0,00015) = 9,83 nebo využitím rovnice (36):pH = pKw – 1/2(pKB – log cB) = 14 – 1/2(7,99 – log 0,4541) = 9,83 Zpět
|
| | |
|
|




 BH+ + OH–
BH+ + OH–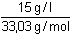 = 0,4541 mol·l–1
= 0,4541 mol·l–1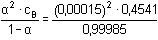 = 1,022·10–8 = 10-7,99
= 1,022·10–8 = 10-7,99