| |
| |
- Příklad 5.79




- Vypočtěte pH 0,001 molárního roztoku dvojsytné slabé kyseliny, jejíž pK1 = 2,0
a pK2 = 3,0 !
Řešení pK1 = 2,00; pK2 = 3,00 V prvním kroku se vypočítá pH jako v případě jednosytné slabé kyseliny podle (45), resp. (31b).pH = 1/2(pK1 – log cH2A) = 1/2(2,00 – log 0,001) = 2,50 Poněvadž vypočítaná koncentrace H+ je menší než 5% koncentrace kyseliny, tj. 2,50 < 1,30 + 3,00, je třeba výpočet upřesnit podle (30):[H+]2 + K1·[H+] – K1·cH2A = 0[H+]2 + 10–2·[H+] – 10–5 = 0 [H+] = 9,16·10–4 mol·l–1  pH1 = 3,04 pH1 = 3,04 Konstanta K2 = 10–3 je větší než 5% vypočítaná koncentrace H+-iontů, tj. pK2 < 1,30 + 3,04, druhý disociační stupeň není zanedbatelný. PodmínkaK2 - 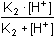 = 10-3 - = 10-3 - 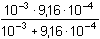 < 0,05 · 9,16·10-4 < 0,05 · 9,16·10-4 přikazuje počítat [H+]celk. podle vztahu (46):[H+]celk. = 9,16·10–4 + 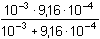 [H+]celk. = 9,16·10 –4 + 4,78·10 –4 = 1,394·10 –3 mol·l –1  pH výsl. = 2,86 Zpět
|
| | |
|
|




 pH1 = 3,04
pH1 = 3,04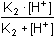 = 10-3 -
= 10-3 - 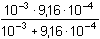 < 0,05 · 9,16·10-4
< 0,05 · 9,16·10-4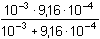
 pHvýsl. = 2,86
pHvýsl. = 2,86