



Řešení Koncentrace amoniaku je dostatečně velká, v roztoku lze očekávat převažující dvouligandový komplex.a) c(NH3) = 0,01 mol·l–1; c(Ag+) = 0,001 mol·l–1 Rovnovážná koncentrace amoniaku: [NH3] = 0,01 – 2·0,001 = 0,008 mol·l–1 Výpočet koeficientu tvorby komplexů α, distribučních koeficientů δ a koncentrací složek podle vztahů (16) a (15):
δ0 = [Ag+] = δ0 · c(Ag+) = 9,66·10-7 mol·l-1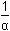 = 10–3,015 = 9,66·10–4 = 10–3,015 = 9,66·10–4  0,0966 % 0,0966 %δ1 = [Ag(NH3)+] = δ1 · c(Ag+) = 1,94·10-5 mol·l-1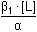 = = 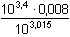 = 0,0194 = 0,0194  1,94 % 1,94 %δ2 = [Ag(NH3)2+] = δ2 · c(Ag+) = 9,80·10-4 mol·l-1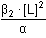 = = 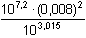 = 0,9799 = 0,9799  97,99 % 97,99 %[NH3] = 0,01 – (1,94·10–5 + 2·9,80·10–4) = 0,00802 mol·l–1 b) c(NH3) = 0,003 mol·l–1; c(Ag+) = 0,001 mol·l–1 Rovnovážná koncentrace amoniaku: [NH3] = 0,003 – 2·0,001 = 0,001 mol·l–1 Výpočet koeficientu tvorby komplexů α, distribučních koeficientů δ a koncentrací složek podle vztahů (16) a (15):
δ0 = [Ag+] = δ0 · c(Ag+) = 5,16·10-5 mol·l-1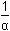 = 10–1,287 = 0,0516 = 10–1,287 = 0,0516  5,16 % 5,16 %δ1 = [Ag(NH3)+] = δ1 · c(Ag+) = 1,30·10-4 mol·l-1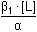 = = 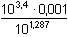 = 0,1297 = 0,1297  12,97 % 12,97 %δ2 = [Ag(NH3)2+] = δ2 · c(Ag+) = 8,18·10-4 mol·l-1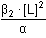 = = 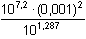 = 0,8185 = 0,8185  81,85 % 81,85 %[NH3] = 0,003 – (1,30·10–4 + 2·8,18·10–4) = 0,00123 mol·l–1 I. Aproximace: [NH3] = 0,00123 mol·l–1; c(Ag+) = 0,001 mol·l–1 Postup je tentýž jako výše podle vztahů (16) a (15). [NH3]výsl. = 0,003 – (1,10·10–4 + 2·8,55·10–4) = 0,00118 mol·l–1. Rozdíl od předchozí koncentrace (0,00123 mol·l–1) činí –4,06 %. II. Aproximace: [NH3] = 0,00118 mol·l–1; c(Ag+) = 0,001 mol·l–1
δ0 = δ1 = 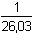 = 0,038 [Ag+] = 3,80·10-5 mol·l-1 = 0,038 [Ag+] = 3,80·10-5 mol·l-1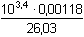 = 0,114 [Ag(NH3)+] = 1,14·10-4 mol·l-1 = 0,114 [Ag(NH3)+] = 1,14·10-4 mol·l-1δ2 = [NH3]výsl. = 0,003 – (1,14·10–4 + 2·8,48·10–4) = 0,00119 mol·l–1.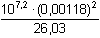 = 0,848 [Ag(NH3)2+] = 8,48·10-4 mol·l-1 = 0,848 [Ag(NH3)2+] = 8,48·10-4 mol·l-1 | ||