|
- Příklad 6.29




- K objemu 20 ml, který obsahuje po 10 ml 0,02 molárního roztoku vápenatých a barnatých iontů,
bylo přidáno 5 ml 0,2M-EDTA a 25 ml pufru o pH 11. Rozhodněte, kterého kationtu bude v roztoku
více a kolikrát!
Řešení Pro výpočet rovnovážných koncentrací složek jsou významnými veličinami jejich celkové látkové koncentrace:c(Ca2+) = c(Ba2+) = (10·0,02)/50 = 0,004 mmol·ml–1 = mol·l–1 = 10–2,40 mol·l–1c(Y4–) = (5·0,2)/50 = 0,02 mmol·ml–1 = mol·l–1 [Y4–] = c(Y4–) – c(Ca2+) – c(Ba2+) = 0,02 – 2·0,004 = 0,012 mol·l–1 = 10–1,92 mol·l–1Rovnovážné koncentrace kovových iontů (5), resp. (21): [Ca2+] = 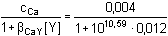 = 8,57·10–12 mol·l–1 = 8,57·10–12 mol·l–1  pCa = 11,07 pCa = 11,07resp. pCa = log (1010,59·10–1,92) – log 10–2,40 = 11,07 [Ba2+] = 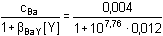 = 5,79·10–9 mol·l–1 = 5,79·10–9 mol·l–1  pBa = 8,24 pBa = 8,24resp. pBa = log (107,76·10–1,92) – log 10–2,40 = 8,24 Poměr koncentrací volných iontů:[Ba2+]/[Ca2+] = 5,79·10–9/8,57·10–12 ≈ 676resp. pCa – pBa = 11,07 – 8,24 = 2,83  [Ba2+]/[Ca2+] = 676 [Ba2+]/[Ca2+] = 676 Barnatých iontů je v roztoku 676krát více než vápenatých.Zpět
|
|




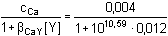 = 8,57·10–12 mol·l–1
= 8,57·10–12 mol·l–1  pCa = 11,07
pCa = 11,07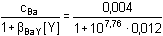 = 5,79·10–9 mol·l–1
= 5,79·10–9 mol·l–1  pBa = 8,24
pBa = 8,24