| |
| |
- Příklad 7.12




- Vypočtěte aktivitní součin rozpustnosti jodičnanu barnatého, je-li v objemu 200 ml nasyceného
roztoku rozpuštěno 80,40 mg Ba(IO3)2!
Řešení Výpočet látkové koncentrace (rozpustnosti) sloučeniny Ba(IO3)2:[Ba(IO3)2] = c = 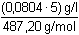 = 8,25·10–4 mol·l–1 = 8,25·10–4 mol·l–1 Sloučenina disociuje podle rovnice:Ba(IO3)2 → Ba2+ + 2 IO3– → c + 2c Koncentrační součin rozpustnosti podle vztahu (6) bude:Ks,c = c·(2c)2 = 4c3 = 4·(8,25·10–4)3 = 2,25·10–9 = 10–8,648 Iontovou sílu roztoku tvoří oba ionty:I = 1/2(8,25·10–4 · 22 + 2·8,25·10–4 · 12) = 0,002475 Střední aktivitní koeficient sloučeniny zjistíme z upravené Debye-Hückelovy rovnice:log f± = –0,509 · 2 · 1 · = -0,0506  f± = 0,890 f± = 0,890 Aktivitní součin rozpustnosti podle (3):Ks,a = Ks,c · f±m+n = 2,25·10–9 · (0,890)3 = 1,59·10–9 resp. podle (5):pKs,a = pKs,c + 3·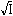 = 8,648 + 3· = 8,648 + 3·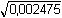 = 8,648 + 0,149 = 8,797 = 8,648 + 0,149 = 8,797Ks,a = 10–8,797 = 1,59·10–9 Zpět
|
| | |
|
|




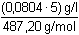 = 8,25·10–4 mol·l–1
= 8,25·10–4 mol·l–1 f± = 0,890
f± = 0,890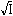 = 8,648 + 3·
= 8,648 + 3·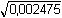 = 8,648 + 0,149 = 8,797
= 8,648 + 0,149 = 8,797