|
- Příklad 8.20




- Roztok objemu 1000 ml obsahuje 0,0063 molu ceru jako ceritou a ceričitou sůl (cCe
= [Ce3+] + [Ce4+]), 0,0024 molu cínu (cSn = [Sn2+]
+ [Sn4+]) a 1 mol HCl. Elektromotorické napětí článku EMN = 0,279 V, ESCE =
0,241V (při 25°C). Jaké jsou látkové koncentrace jednotlivých složek v roztoku a jakou
hodnotu má rovnovážná konstanta reakce?
Řešení Vypočítat rovnovážnou konstantu dvouelektronové reakce2 Ce4+ + Sn2+  2 Ce3+ + Sn4+ 2 Ce3+ + Sn4+ lze podle vztahu (13). Hodnoty formálních potenciálů redoxních párů v prostředí 1M-HCl nalezneme v tabulce 12.log Kr = log 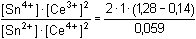 = 38,644 = 38,644  Kr = 4,41·1038 Kr = 4,41·1038 Varianta řešení I: využití rovnovážné konstanty reakce log Kr = log 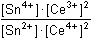  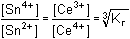 a) 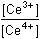 = = 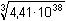 = 7,61·1012 = = 7,61·1012 = 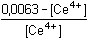 Výsledek: [Ce4+] = 8,28·10–16 mol·l–1 a [Ce3+] ≈ 0,0063 mol·l–1 b) 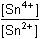 = = 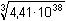 = 7,61·1012 = = 7,61·1012 = 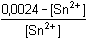 Výsledek: [Sn2+] = 3,15·10–16 mol·l–1 a [Sn4+] ≈ 0,0024 mol·l–1 Varianta řešení II: využití Nernst-Petersovy rovnice Potenciál indikační elektrody se vypočítá z hodnoty EMN (kap.7, rov. (20)):EMN = Eind – ESCE  Eind = 0,279 + 0,241 = 0,520 V Eind = 0,279 + 0,241 = 0,520 V a) [Ce4+] + [Ce3+] = 0,0063 mol·l–1 0,520 = 1,28 + 0,059 log 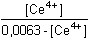 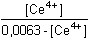 = 1,314·10 –13 b) [Sn2+] + [Sn4+] = 0,0024 mol·l–10,520 = 0,14 +  log log 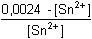 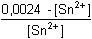 = 7,609·10 12 Reakce mezi ionty Ce4+ a Sn2+ proběhla kvantitativně.Zpět
|
|




 2 Ce3+ + Sn4+
2 Ce3+ + Sn4+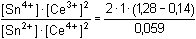 = 38,644
= 38,644  Kr = 4,41·1038
Kr = 4,41·1038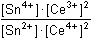

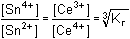
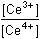 =
= 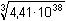 = 7,61·1012 =
= 7,61·1012 = 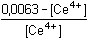
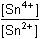 =
= 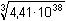 = 7,61·1012 =
= 7,61·1012 = 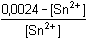
 Eind = 0,279 + 0,241 = 0,520 V
Eind = 0,279 + 0,241 = 0,520 V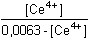
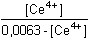 = 1,314·10–13
= 1,314·10–13 log
log 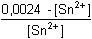
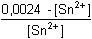 = 7,609·1012
= 7,609·1012