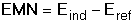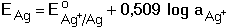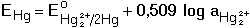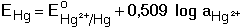| |||||
|
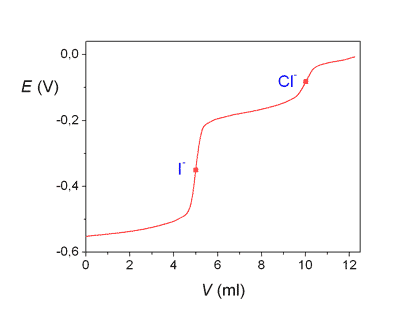
Průběh srážecích titrací je často indikován potenciometricky měřením elektromotorického napětí (EMN) článku tvořeného indikační (Eind) a srovnávací (Eref) elektrodou. Potenciál indikační elektrody je určen Nernstovou rovnicí (pro 25°C) kde Eo jsou standardní potenciály. Při potenciometrické indikaci bodu ekvivalence lze titrovat i více iontů tvořících sraženinu s odměrným činidlem. Na obrázku 2 je znázorněna titrační křivka argentometrické titrace směsi chloridů a iodidů. Spotřeba do prvního bodu ekvivalence odpovídá koncentraci iodidů ve vzorku (rozpustnost AgI je menší než rozpustnost AgCl). Koncentrace chloridů je úměrná objemu odměrného roztoku mezi oběma body ekvivalence. Obr 2. Grafické znázornění průběhu titrace 5 ml směsi 0,01 M-KI a 0,01 M-NaCl odměrným roztokem 0,01 M-AgNO3. Potenciometrická indikace bodu ekvivalence se stříbrnou indikační a merkurosulfátovou referentní elektrodou. Veličina E představuje EMN článku. Řešené příklady:
| ||
| |||||