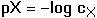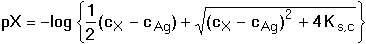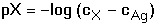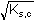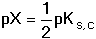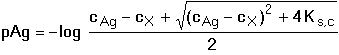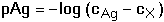| |||||
|
Srážecích titrací se v odměrné analýze poměrně málo používá. Důvodem je obvykle pomalá a nestechiometrická tvorba sraženin. Zvlášť nepříznivě se uplatňují jevy koprecipitace, a to zejména v okolí bodu ekvivalence. Nejrozšířenější jsou metody využívající tvorby málo rozpustných stříbrných nebo rtuťných halogenidů. Titrační křivka pak vyjadřuje závislost pAg nebo pX na přidávaném titračním činidle, příp. na ekvivalentovém zlomku a. Je-li mocenství reagujících iontů stejné, křivka je souměrná kolem bodu ekvivalence. Při přesném výpočtu průběhu titrační křivky je třeba uvážit, že rozpustnost sraženiny se mění podle iontové síly roztoku, což se zvlášť projeví v okolí bodu ekvivalence. Hlavní body titrační křivky pX = f(a) při vzniku sraženiny AgX, kde a = cAg/cX, jsou: a) a = 0 [X-] = cX b) a < 1 cAg = [Ag+] + [AgX]↓ cX = [X–] + [AgX]↓
[X–] = [X–]r + [X–]s , kde však
[X–]s = [Ag+]s
Ks,c = [X–]s · (cX – cAg +
[X–]s)
[X–]s2 + (cX –
cAg)[X–]s – Ks,c = 0
[X–] = (cX – cAg) + 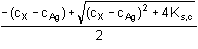
c) a = 1 [X-] = [Ag+] =
d) a > 1
[Ag+] = [Ag+]r + [Ag+]s =
(cAg – cX) + [Ag+]s
Protože [Ag+]s = [X-]s, pro součin rozpustnosti
bude platit
Ks,c = (cAg – cX + [Ag+]s) ·
[Ag+]s
[Ag+]s2 + (cAg – cX)
[Ag+]s – Ks,c = 0
[Ag+] = (cAg – cX) +
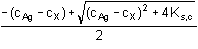
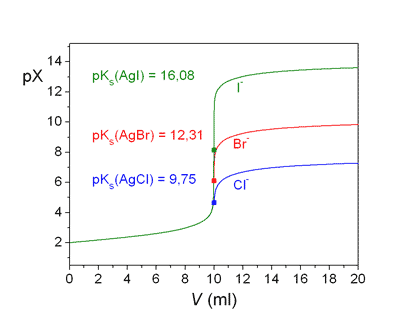
Průběhy titračních křivek pro dané ionty závisí jednak na hodnotách součinů rozpustnosti, jednak na koncentracích titrovaného iontu a odměrného roztoku titračního činidla. S klesající hodnotou součinu rozpustnosti (klesající rozpustností sraženiny) roste skok na titrační křivce v bodě ekvivalence (obr. 1). Skok roste také s rostoucí koncentrací titrovaného iontu i odměrného roztoku titračního činidla. Obr 1. Grafické znázornění průběhu titrace 10 ml roztoku 0,01 mol·l-1 halogenidového iontu X odměrným roztokem 0,01 M-AgNO3. Řešené příklady:
| ||
| |||||