



Řešení Řešení podle vztahů (4) a (5).a) Systém 0,01M-FeCl3 + 0,025M-FeCl2
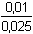 = 0,771 – 0,023 = 0,748 V = 0,771 – 0,023 = 0,748 V
Fe3+ Cl– Fe2+ Cl–
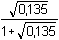 = – 1,2309 = – 1,2309  fFe(III) = 0,0588 fFe(III) = 0,0588log Fe(II) = –0,509 ·22· E = 0,771 + 0,059 log 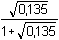 = – 0,5471 = – 0,5471  fFe(II) = 0,2837 fFe(II) = 0,2837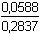 + 0,059 log + 0,059 log 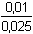 = 0,771 – 0,040 – 0,023 = 0,708 V = 0,771 – 0,040 – 0,023 = 0,708 V
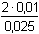 = 0,771 – 0,006 = 0,765 V = 0,771 – 0,006 = 0,765 V
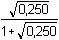 = – 1,5255 = – 1,5255  fFe(III) = 0,0298 fFe(III) = 0,0298log Fe(II) = –0,509 ·22· 0,3333 = – 0,6780 E = 0,771 + 0,059 log  fFe(II) = 0,2099 fFe(II) = 0,2099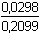 + 0,059 log + 0,059 log 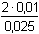 = 0,771 – 0,050 – 0,006 = 0,715 V = 0,771 – 0,050 – 0,006 = 0,715 V | ||