Řešení: a) pH roztoku na začátku titrace - v roztoku je pouze kyselina, výpočet pH provedeme podle vztahu (45):
Vypočtená hodnota nesplňuje podmínku správnosti - upravíme podle (30):
[H3O+] = 0,02307 mol·l-1
pH = 1,64
b) pH roztoku před bodem ekvivalence - v roztoku bude směs kyseliny fosforečné a dihydrogenfosforečnanu. Počítáme podle vztahu (76). Přídavek 1 ml 0,1M-NaOH:
[H2PO4-] = 1,0 · 0,1/6 = 0,01667
mol·l-1
pH = 2,16 + log 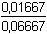 = 1,56 = 1,56
Tato hodnota pH nesplňuje podmínku správnosti, neboť 0,05·0,01667 < 10-1,56 > 0,05·0,06667. Správnější hodnotu [H3O+] vypočítáme podle vztahu (75):
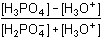
[H3O+]2 + ([H2PO4-]
+ K1)[H3O+] – K1[H3PO4] = 0
[H3O+]2 + (0,01667 +
6,918·10–3)[H3O+] – 6,918·10–3
· 0,06667 = 0
[H3O+] = 0,01167 mol·l-1
pH = 1,93
Po přídavku 2,5 ml 0,1M-NaOH je zneutralizováno 50% kyseliny do 1.titračního stupně:
c) pH roztoku v bodě 1.ekvivalence - (5 ml 0,1M-NaOH), roztok obsahuje pouze amfolyt. Přibližnou hodnotu pH lze vypočítat podle (73):
Správnější výsledek získáme podle vztahu (72), neboť mezi hodnotou rovnovážné koncentrace amfolytu a hodnotou konstanty K1 není rozdíl příliš velký:
d) pH roztoku za bodem 1.ekvivalence - roztok obsahuje směs dihydrogen- a hydrogenfosforečnanu, použijeme opět vztahu (76). Přídavek 6 ml 0,1M-NaOH:
[H2PO4-] = (5 – 1)·0,1/11 = 0,03636
mol·l-1
pH = 7,21 + log 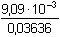 = 6,61 = 6,61
Přídavek 7,5 ml 0,1M-NaOH:
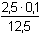 = 0,02 mol·l-1 = 0,02 mol·l-1
pH = pK2 = 7,21
e) pH roztoku v bodě 2.ekvivalence - (10 ml 0,1M-NaOH), roztok obsahuje pouze amfolyt hydrogenfosforečnan. Hodnotu pH vypočítáme podle (73):
[H3O+] =
pH = 9,66
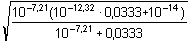 =
2,19·10–10 mol·l-1 =
2,19·10–10 mol·l-1f) pH roztoku za bodem 2.ekvivalence - roztok obsahuje směs hydrogenfosforečnanu a fosforečnanu, použijeme tedy vztah (76). Přídavek 12 ml 0,1M-NaOH:
[HPO42-] = (5 – 2)·0,1/17 = 0,01765 mol·l-1
pH = 12,32 + log 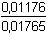 = 12,14 = 12,14
Pro získání přesnějších hodnot pH je třeba vzít do úvahy iontovou sílu roztoku v jednotlivých fázích titrace: a) I = 0,123 (výpočet ze stupně disociace), pH = 1,58;
b) I = 0,01667, pH = 1,45 (1,83); I = 0,0333, pH = 2,01;
c) I = 0,05, pH = 4,41 (4,45);
d) I = 0,0636, pH = 6,41; I = 0,08, pH = 6,99;
e) I = 0,099, pH = 9,16 (9,12);
f) I = 0,123, pH = 11,36.
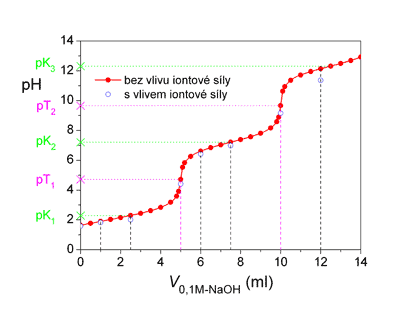
Titrační křivka pro titraci 5 ml 0,1M-H3PO4 odměrným roztokem 0,1M-NaOH.
Přídavky 1 ml, 2,5 ml, 5 ml, 6 ml, 7,5 ml, 10 ml a 12 ml titračního činidla jsou vyznačeny čárkovanou svislou čárou.
| ||