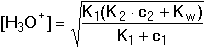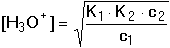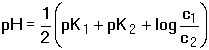| |||||
|
5.9.4. Titrace vícesytné slabé kyseliny nebo směsi několika jednosytných kyselin silnou zásadou Vícesytné kyseliny je možno titrovat po jednotlivých stupních. Pokud hodnoty sousedních disociačních konstant jsou dostatečně rozdílné (ΔpK ≈ 4), získá se několik oddělených bodů ekvivalence. Kyseliny, resp. disociační stupně vícesytných kyselin, jejichž pK(HiA) > 8, nelze již titrovat s dostatečnou spolehlivostí. Základní vztahy pro výpočet jednotlivých bodů křivky jsou uvedeny v kap. 5.3.4., (5.3.3.), 5.5., 5.6., 5.4.1., 5.2.2. Řešený příklad:
Při titraci směsi dvou nebo více různě disociovaných slabých jednosytných kyselin je třeba uvažovat koncentrace všech kyselin. Podobným postupem jako u vztahu (70) lze odvodit vztah pro hodnotu pH první ekvivalence:
kde c1 a K1 jsou koncentrace a disociační konstanta silnější kyseliny, c2 a K2 jsou koncentrace a disociační konstanta slabší kyseliny. Je-li (K2·c2) » Kw a c1 » K1, pak
Řešený příklad:
| ||
| |||||