| |
| |
- Příklad 5.20




- Vypočítejte pH směsi vzniklé smícháním 180 ml 0,2M-H2SO4
a 359 ml 0,2M-NaOH! Uvažujte vliv iontové síly roztoku!
Řešení Řešení podle upravené rovnice (16) v kap.1.180 · (0,2 · 2) – 359 · 0,2 = (180 + 359) · c(H+)n(H+) n(OH-) c(H+) = 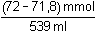 = 3,71·10–4 mmol·ml-1 = mol·l-1 = 3,71·10–4 mmol·ml-1 = mol·l-1 Iontovou sílu roztoku tvoří H+, SO42– a Na+-ionty:I = 0,5 (3,71·10–4 · 12 + 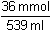 · 22 + · 22 + 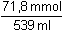 · 12) = 0,2004 · 12) = 0,2004 Aktivitní koeficient je určen vztahy (9) a (7):- log fH+ = 0,509 · 12 · 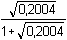 = 0,1574 = 0,1574  fH+ = 0,969 fH+ = 0,969 Aktivita H+-iontu (4): 3,71·10–4 · 0,696 = 2,582·10–4 mol·l-1  pH = 3,59 pH = 3,59Zpět
|
| | |
|
|




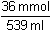 · 22 +
· 22 + 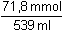 · 12) = 0,2004
· 12) = 0,2004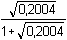 = 0,1574
= 0,1574  fH+ = 0,969
fH+ = 0,969 pH = 3,59
pH = 3,59