| |
| |
- Příklad 7.69




- Objem 50 ml roztoku jodidu draselného koncentrace 0,02 mol·l-1 byl titrován
roztokem AgNO3 téže koncentrace. Vypočtěte hodnoty pI a EAg (systém
elektrod Ag – SCE) po přídavcích a) 0 ml; b) 10 ml; c) 49,98 ml; d) 50 ml; e) 55 ml titračního
činidla. Uvažujte vliv iontové síly roztoku!
Řešení Argentometrické stanovení 50 ml 0,02 molárního roztoku jodidů. Výpočet hodnoty pI po jednotlivých přídavcích titrantu se provede podle rovnic (15)–(19).pKs(AgI) = 16,08; E°Ag+/Ag = 0,799 V a) Počátek titrace: pI = –log c(I–) = –log 0,02 = 1,70Potenciál stříbrné elektrody je definován Nernstovou rovnicí (21) a součinem rozpustnosti pro danou koncentraci iontů (10). Iontová síla roztoku: I = 0,02pKs,c = pKs(AgI) – 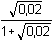 = 16,08 – 0,124 = 15,956 Ks,c = 1,107·10–16 = 16,08 – 0,124 = 15,956 Ks,c = 1,107·10–16E Ag = E° Ag+/Ag + 0,509 log 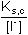 = 0,799 + 0,059 log 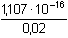 = –0,042 V b) Přídavek 10 ml 0,02M-AgNO3:Aktuální koncentrace jodidů v objemu 60 ml:[I–] = 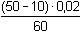 = 1,333·10–2 mol·l–1 = 1,333·10–2 mol·l–1  pI = 1,88 pI = 1,88 Iontovou sílu roztoku tvoří ionty K+, I– a NO3–:I = 1/2(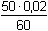 · 12 + 0,01333 · 12 + · 12 + 0,01333 · 12 + 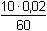 · 12) = 0,0167 · 12) = 0,0167pK s,c = pK s(AgI) - 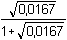 = 16,08 – 0,114 = 15,966 K s,c = 1,081·10 –16 Potenciál stříbrné elektrody je podle (21)EAg = 0,799 + 0,059 log 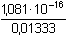 = 0,799 + 0,059 log 10–14,086 = –0,032 V = 0,799 + 0,059 log 10–14,086 = –0,032 V c) Přídavek 49,98 ml 0,02M-AgNO3:Aktuální koncentrace jodidů v objemu téměř 100 ml (chybí pouze 0,02 ml do bodu ekvivalence).[I–] = 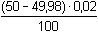 = 4·10–6 mol·l–1 = 4·10–6 mol·l–1  pI = 5,40 pI = 5,40 Zda disociace sraženiny AgI je významná se zjistí porovnáním výsledku s kořenem kvadratické rovnice (16). V případě disociace platí: [Ag+]dis = [I–]disIontovou sílu roztoku tvoří pouze K+ a NO3–, I = 0,01 pKs,c = pKs(AgI) - 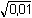 = 16,08 – 0,1 = 15,98 Ks,c = 1,047·10–16 = 16,08 – 0,1 = 15,98 Ks,c = 1,047·10–16Ks,c = 1,047·10–16 = [Ag+]dis · [I–]celk = [I–]dis (4·10–6 + [I–]dis) [I–]dis2 + 4·10-6 [I–]dis - 1,047·10-16 = 0[I–]dis = 2,617·10–11 mol·l–1 což je hodnota zcela zanedbatelná vůči zbývající koncentraci jodidu v roztoku (4·10–6 mol·l–1); disociace sraženiny je tedy nevýznamná.Potenciál stříbrné elektrody je podle (21) EAg = 0,799 + 0,059 log 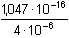 = 0,799 + 0,059 log 10–10,58 = 0,175 V = 0,799 + 0,059 log 10–10,58 = 0,175 V d) Přídavek 50,00 ml 0,02M-AgNO3:V bodě ekvivalence (vztah (18)) platí: [Ag+]dis = [I–]dis = 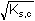 Iontovou sílu tvoří pouze ionty K+ a NO3–: I = 0,01 pKs,c = pKs(AgI) - 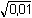 = 16,08 – 0,1 = 15,98 Ks,c = 1,047·10–16 = 16,08 – 0,1 = 15,98 Ks,c = 1,047·10–16[I –] = 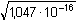 = 1,023·10 –8 mol·l –1  pI = 7,99 Potenciál stříbrné elektrody je podle (21) EAg = 0,799 + 0,059 log 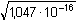 = 0,799 + 0,059 log 10–7,99 = 0,328 V = 0,799 + 0,059 log 10–7,99 = 0,328 V e) Přídavek 55,00 ml 0,02M-AgNO3:Za bodem ekvivalence je nadbytek titrantu (Ag+), rovnovážná koncentrace jodidů bude určena součinem rozpustnosti při nadbytku stříbrných iontů, vztah (12b).[Ag+] = 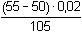 = 9,52·10–4 mol·l–1 = 10–3,02 mol·l–1 = 9,52·10–4 mol·l–1 = 10–3,02 mol·l–1 Iontovou sílu roztoku tvoří ionty K+, NO3– a Ag+:I = 1/2 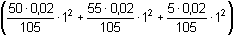 = 0,0105 ≈ 0,01 = 0,0105 ≈ 0,01 Hodnota součinu rozpustnosti tedy bude tatáž jako u přídavku c) nebo d). Koncentrace jodidů volných v roztoku, resp. pI, bude podle (12b)[I–] = 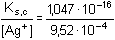 = 1,10·10–13 mol·l–1 = 10–12,96 mol·l–1 = 1,10·10–13 mol·l–1 = 10–12,96 mol·l–1pI = pKs,c – pAg = 15,98 – 3,02 = 12,96 Potenciál stříbrné elektrody je podle (21)EAg = 0,799 + 0,059 log 10-3,02 = 0,621 V Zpět
|
| | |
|
|




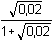 = 16,08 – 0,124 = 15,956 Ks,c = 1,107·10–16
= 16,08 – 0,124 = 15,956 Ks,c = 1,107·10–16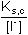 = 0,799 + 0,059 log
= 0,799 + 0,059 log 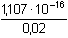 = –0,042 V
= –0,042 V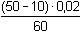 = 1,333·10–2 mol·l–1
= 1,333·10–2 mol·l–1  pI = 1,88
pI = 1,88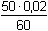 · 12 + 0,01333 · 12 +
· 12 + 0,01333 · 12 + 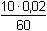 · 12) = 0,0167
· 12) = 0,0167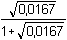 = 16,08 – 0,114 = 15,966 Ks,c = 1,081·10–16
= 16,08 – 0,114 = 15,966 Ks,c = 1,081·10–16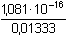 = 0,799 + 0,059 log 10–14,086 = –0,032 V
= 0,799 + 0,059 log 10–14,086 = –0,032 V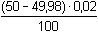 = 4·10–6 mol·l–1
= 4·10–6 mol·l–1  pI = 5,40
pI = 5,40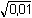 = 16,08 – 0,1 = 15,98 Ks,c = 1,047·10–16
= 16,08 – 0,1 = 15,98 Ks,c = 1,047·10–16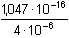 = 0,799 + 0,059 log 10–10,58 = 0,175 V
= 0,799 + 0,059 log 10–10,58 = 0,175 V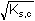
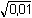 = 16,08 – 0,1 = 15,98 Ks,c = 1,047·10–16
= 16,08 – 0,1 = 15,98 Ks,c = 1,047·10–16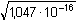 = 1,023·10–8 mol·l–1
= 1,023·10–8 mol·l–1  pI = 7,99
pI = 7,99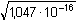 = 0,799 + 0,059 log 10–7,99 = 0,328 V
= 0,799 + 0,059 log 10–7,99 = 0,328 V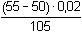 = 9,52·10–4 mol·l–1 = 10–3,02 mol·l–1
= 9,52·10–4 mol·l–1 = 10–3,02 mol·l–1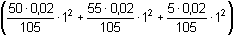 = 0,0105 ≈ 0,01
= 0,0105 ≈ 0,01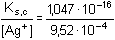 = 1,10·10–13 mol·l–1 = 10–12,96 mol·l–1
= 1,10·10–13 mol·l–1 = 10–12,96 mol·l–1