



Řešení Množství vytitrovaného jodidu představuje rozdíl původního množství 0,05 mol·l–1 (tj. 100%) a množství jodidu zbývajícího v roztoku. Tato rovnovážná koncentrace jodidů je určena součinem rozpustnosti AgI a koncentrací Ag+-iontů, kterou definuje Nernstova rovnice (21).
–0,040 = 0,799 + 0,059 log aAg+ log aAg+ = –14,22  aAg+ = 6,02·10–15 mol·l–1 aAg+ = 6,02·10–15 mol·l–1
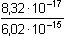 = 0,0138 mol·l–1 = 0,0138 mol·l–1resp. pI = pKs – pAg = 16,08 – 14,22 = 1,86  [I–] = 0,0138 mol·l–1 [I–] = 0,0138 mol·l–1Množství jodidů ve sraženině AgI: w = 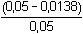 · 100 = 72,40 % · 100 = 72,40 %b) Podle rovnic (20) a (21): EMN = –0,223 V = EAg – ESCE 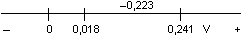 Řešení je zcela analogické postupu a).
| ||