|
- Příklad 7.74




- Vypočtěte součin rozpustnosti bromidu stříbrného při standardních podmínkách, jestliže
při titraci 0,05 molárního roztoku bromidu draselného roztokem 0,1M-AgNO3 bylo
naměřeno v bodě ekvivalence EMN = 0,199 V. Uvažujte vliv iontové síly roztoku! ESCE =
0,241 V při 25°C.
Řešení V bodě ekvivalence argentometrické titrace bromidů platí (18).[Br–] = [Ag+] =  Je-li EMN článku +0,199 V, stříbrná elektroda má podle (20), (21) potenciál:EAg = 0,199 + 0,241 = 0,440 VE Ag = 0,440 V = 0,799 + 0,059 log  a součin rozpustnosti: Ks,c = 6,7688·10–13  pKs,c = 12,17 pKs,c = 12,17Iontovou sílu roztoku tvoří ionty K+ a NO3–. Vzhledem k rozdílné koncentraci KBr a AgNO3 bude objem KBr dvojnásobný oproti titrantu, neboť pro bod ekvivalence platí nKBr = nAgNO3  2·0,05 = 1·0,1 2·0,05 = 1·0,1I = 1/2 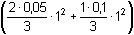 = 0,033 Součin rozpustnosti za standardních podmínek lze vypočítat podle několika postupů. Výpočet podle rovnice (3):log fAg+ = log fBr– = –0,509·12·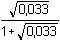 = –0,0782 = log f± = –0,0782 = log f±  fi = f± = 0,835 fi = f± = 0,835Ks = Ks,c · f2 = 6,7688·10–13·(0,835)2 = 4,72·10–13 = 10-12,326 Výpočet podle rovnice (4):pKs = pKs,c – (m+n) log f± = 12,17 – 2 (–0,0782) = 12,326  Ks = 4,72·10–13 Ks = 4,72·10–13 Výpočet podle rovnice (5):pKs = 12,17 + 1· 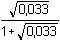 = 12,17 + 0,154 = 12,324 = 12,17 + 0,154 = 12,324  Ks = 4,74·10–13 Ks = 4,74·10–13 Poznámka: Drobná odchylka ve výpočtu konstanty podle vztahu (5) od postupu podle (3) a (4) je způsobena zaokrouhlením číselné veličiny v Debye-Hückelově rovnici (veličina 0,5 u vztahu (5) oproti 0,509).Zpět
|
|






 pKs,c = 12,17
pKs,c = 12,17 2·0,05 = 1·0,1
2·0,05 = 1·0,1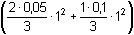 = 0,033
= 0,033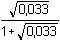 = –0,0782 = log f±
= –0,0782 = log f±  fi = f± = 0,835
fi = f± = 0,835 Ks = 4,72·10–13
Ks = 4,72·10–13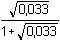 = 12,17 + 0,154 = 12,324
= 12,17 + 0,154 = 12,324  Ks = 4,74·10–13
Ks = 4,74·10–13