| |
| |
VIII.2. Konduktometrie nepřímá – (konduktometrické titrace)
- Příklad VIII.2.1




- Vypočítejte procentuální změnu specifické vodivosti (konduktivity) při titraci 0,005M-HNO3
roztokem 0,1M-NaOH od počátku do bodu ekvivalence (25 °C):
a) neobsahuje-li kromě titrované kyseliny další vodivé složky a změna objemu v ekvivalenci je zanedbatelná;
b) je-li konduktivita titrovaného roztoku na počátku titrace zvýšena neutrální solí na hodnotu
0,02 S·cm–1.
- Příklad VIII.2.2




- Roztok obsahující 0,01 molu BaCl2 ve velkém zředění je titrován roztokem
Li2SO4 (25 °C). Vypočtěte molární vodivost roztoku za předpokladu, že změna
objemu je zanedbatelná: a) na začátku titrace,
b) v bodě ekvivalence, c) po přídavku 0,02 molu
Li2SO4. Jaký tvar bude mít titrační křivka?
- Příklad VIII.2.3




- Vzorek směsi kyseliny octové a chlorovodíkové byl v 50 ml odměrné baňce doplněn redestilovanou vodou
po značku. Alikvotní objem 10 ml byl odebrán do kádinky a k němu bylo přidáno 90 ml redestilované vody.
Vzorek byl titrován odměrným roztokem 0,5023 M-NaOH s konduktometrickou indikací bodu ekvivalence.
V průběhu titrace byly zaznamenány následující hodnoty vodivosti G:
| V (ml) | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10
| | G (mS) | 6,039 | 4,512 | 3,016 | 1,633 | 1,874 | 2,111 | 2,344 | 2,850 | 3,815 | 4,761 | 5,692
|
Sestrojte titrační křivku z hodnot korigované vodivosti 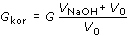 , kde
V0 je počáteční objem titrovaného roztoku a VNaOH objem
přidaného titračního činidla, a určete hmotnostní koncentrace jednotlivých kyselin v původním objemu
50 ml vzorku. Mr(HC1) = 36,465; Mr(CH3COOH) = 60,054. , kde
V0 je počáteční objem titrovaného roztoku a VNaOH objem
přidaného titračního činidla, a určete hmotnostní koncentrace jednotlivých kyselin v původním objemu
50 ml vzorku. Mr(HC1) = 36,465; Mr(CH3COOH) = 60,054.
|
| | |
|
|